L’état de choc
L’état de choc peut se définir comme un déficit énergétique des cellules. Plusieurs mécanismes, nerveux et hormonaux, sont activés pour le compenser. L’augmentation du débit cardiaque, la vasoconstriction généralisée et la rétention hydrosodée permettent de maintenir la perfusion de tous les organes. Si l’hypoxie persiste, les apports énergétiques restent insuffisants et l’organisme décompense. Une vasoconstriction périphérique dirige le sang prioritairement vers les organes vitaux : le coeur, l’encéphale et les reins. Les régions les moins bien irriguées assurent leur métabolisme grâce à l’anaérobiose. Au stade terminal, les réserves s’épuisent et la vasoconstriction périphérique n’est plus possible : c’est le collapsus cardiovasculaire [1—6].
Le SRIS
Un certain nombre d’affections ont des conséquences physiopathologiques communes. Le choc septique, le pyomètre, la pancréatite, la dilatation torsion de l’estomac, le coup de chaleur, les traumatismes multiples, l’envenimation, la virémie, certaines parasitoses ou encore le développement d’une tumeur peuvent provoquer une libération massive de médiateurs de l’inflammation : tumor necrosis factor (TNF ou facteur de nécrose tumorale), interleukines, platelet activating factor (PAF ou facteur d’activation plaquettaire), prostaglandines, leukotriènes, lyzozymes, interféron
et radicaux libres. Ces substances, libérées massivement, peuvent affecter le système cardiovasculaire. Elles peuvent entraîner une augmentation de la perméabilité vasculaire, une diminution de la contractilité cardiaque, des arythmies et provoquer une hypovolémie relative. C’est le syndrome de réponse inflammatoire systémique (SRIS). Un animal est considéré comme développant un SRIS si deux ou plus des critères listés dans le Tableau 1 sont détectés. Le SRIS, s’il n’est pas contrôlé, évolue vers un état de choc [1—3].

Le traitement du SRIS et de l’état de choc repose sur le soutien des paramètres vitaux. L’American Animal Hospital Association a défini quatre paramètres vitaux : le pouls, la respiration, la température et la douleur. Leur soutien se fait par l’identification précoce et le traitement de l’affection déclenchante, l’apport d’oxygène, le soutien de la fonction cardiovasculaire et l’établissement d’un plan d’analgésie efficace. Le soutien de la fonction cardiovasculaire implique souvent l’administration de fluides pour restaurer ou maintenir la volémie [1—8].
La répartition des fluides dans l’organisme
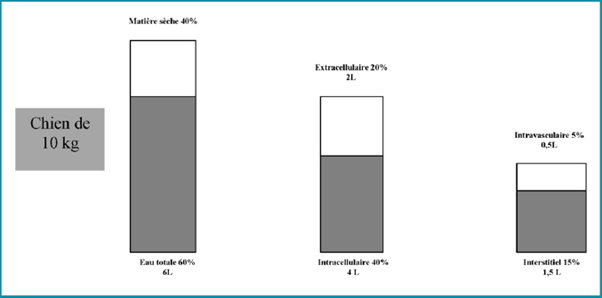
Figure 1. Répartition de l’eau dans l’organisme d’un chien de 10 kg.
Schématiquement, l’organisme se divise en trois compartiments (Fig. 1) : le compartiment intracellulaire (66 % de la masse d’eau) et le compartiment extracellulaire, lui-même divisé en deux compartiments, interstitiel (24 % de la masse d’eau) et vasculaire (10 % de la masse d’eau) [3,9—11]. Nous n’avons accès, par l’intermédiaire des cathéters, qu’aux vaisseaux sanguins. Il est alors indispensable de comprendre les principales règles qui régissent les échanges entre ces milieux.
Brièvement, les échanges entre les milieux intra- et extracellulaires sont régulés par les règles de l’osmose. Lorsque les concentrations en molécules osmotiquement actives (sodium, potassium, calcium, magnésium, chlorures, bicarbonates, sulfates, lactates, glucose, protéines, urée. . .) sont différentes de part et d’autre de la membrane cellulaire un mouvement d’eau est provoqué depuis
le compartiment le moins concentré vers le plus concentré. L’osmolalité d’un milieu est définie par le nombre de particules osmotiquement actives. L’osmolalité d’un soluté, comparée à celle de la cellule, permet d’en définir la tonicité. Les échanges avec le milieu intracellulaire en dépendent. Une solution isotonique n’échangera pas d’eau avec l’espace intracellulaire. Une solution hypotonique promouvra le passage de liquide depuis l’espace interstitiel vers le milieu intracellulaire. Une solution hypertonique provoquera des mouvements d’eau depuis l’espace intracellulaire
vers l’espace interstitiel [3,9—11].
Les échanges entre les vaisseaux et le milieu interstitiel se font dans les capillaires dont la membrane est perméable aux molécules d’un poids moléculaire inférieur à 60 000 Da.
C’est le cas des ions. Elle ne laisse pas passer les protéines, comme l’albumine qui sont responsables de la pression oncotique et de l’effet de Gibbs-Donnan. Les échanges dans les capillaires dépendent de la loi de Starling.
Filtration nette = Kf[(Pcap − Pint) − (ΠP − Πint)]
Où Kf : perméabilité du capillaire, Pcap : pression hydrostatique dans le capillaire, Pint : pression interstitielle dans le milieu interstitiel,Πp : pression oncotique résultant des protéines plasmatiques et Πint : pression oncotique résultant des protéines dans le milieu interstitiel (protéines filtrées plus mucopolysaccharides) [3,9—11].
La composition des solutés
Les cristalloïdes contiennent des molécules de petite taille, des ions, qui peuvent traverser librement la barrière capillaire. Une fois injectés dans les vaisseaux, la pression hydrostatique des capillaires est augmentée et la filtration nette augmente jusqu’à l’établissement d’un nouvel équilibre. Les solutions de glucose 5 % sont initialement isotoniques [8], mais le glucose est rapidement métabolisé. Il ne reste alors que de l’eau pure, hypotonique [12], et 91 % du liquide administré quitte l’espace intravasculaire pour se repartir dans les espaces interstitiel (25 %) et intracellulaire (66 %) en quelques minutes [5,6,9,12,13].
Le NaCl 0,9 %, le Ringer lactate®, les mélanges (2/3 glucose 5 % + 1/3 Ringer lactate®, 1/2 glucose 5 % + 1/2 Ringer lactate®) sont isotoniques. Il n’y a pas d’échange avec le milieu intracellulaire. Au bout de 40 minutes, 80 % du liquide se trouve dans l’espace interstitiel et 20 % dans les vaisseaux [5,6,8,9,12,13].
Les NaCl 7, 5, 10 et 23 % sont hypertoniques. Leur forte tonicité leur confèrent la capacité d’attirer l’eau depuis les espaces intracellulaire et interstitiel vers le compartiment vasculaire en quelques minutes [5,6,8,9,12,13].
Les colloïdes, solutés isotoniques, contiennent des molécules de haut poids moléculaire (albumine, hémoglobine, plaquettes. . .) qui ne traversent pas la barrière capillaire.
On distingue les colloïdes naturels (sang frais, plasma frais ou congelé) et les colloïdes de synthèse (dextrans, HEA) [5,6,8,9,12,13].
Il existe enfin des mélanges de solutés hypertoniques (NaCl 7,5 %) et de colloïdes (dextran ou HEA). Il est cependant difficile de se les procurer car leur usage est réservé au milieu hospitalier [2,4,6,12-14].
Les propriétés des solutés
La tonicité d’un fluide et l’aptitude de ses composants à passer la barrière capillaire définissent son pouvoir d’expansion volumique. C’est sa capacité à attirer le liquide interstitiel vers le compartiment vasculaire. Par exemple, si une solution produit une expansion volémique de 200 %, cela signifie que pour 100mL de solution administrés 100mL de liquide extravasculaire vont être attirés dans les vaisseaux. Avec 100mL de produit on aura augmenté la volémie de 200 mL. La durée d’action d’un produit est une donnée importante à prendre en compte.
Pour traiter un état de choc, les solutions hypotoniques sont à proscrire. Elles n’ont aucun pouvoir de restauration de la volémie.
Les solutés isotoniques permettent un remplissage vasculaire rapide, mais 80 % passent la barrière capillaire en moins d’une heure.
Les hypertoniques, par leur osmolalité élevée, permettent une expansion volémique de plus de 700 %. Elle n’est cependant pas durable et, au bout de quelques heures, on assiste à un retour des liquides dans les compartiments extravasculaires.
Les molécules de grande taille des dextrans et HEA augmentent la pression oncotique du sang. Ils produisent une expansion volémique de 137 à 210 % en 30 à 60 minutes. Leur durée d’action est comprise entre 12 et 48 heures [9,10,15].
Les colloïdes naturels sont utilisés pour corriger les modifications biochimiques et hématologiques. Le sang frais contient des globules rouges, de l’albumine, tous les facteurs de coagulation, des leucocytes, des plaquettes et de l’antithrombine.
Le plasma frais contient des albumines, les facteurs de coagulation et de l’antithrombine. Le plasma congelé a la même composition que le plasma frais à cela près qu’il contient moins de facteur V et de facteur VIII. Aucun de ces solutés naturels ne permet de restaurer la volémie. Ils ne sont administrés que dans l’objectif de complémenter l’animal. Enfin, leur durée d’action importe peu car leur utilisation se fait à effet [9,10,15-17].
Quel soluté choisir ?
Une fois qu’il a été établi que l’état de l’animal nécessitait une réanimation, une évaluation précise de l’animal va guider le choix des fluides à administrer (Fig. 2). Le premier fluide administré est systématiquement un cristalloïde isotonique. Son action est complétée par un autre soluté au besoin. Si l’albuminémie, dont la pression oncotique dépend, est en dessous de 20 g/L ou que l’animal présente une coagulopathie, il est essentiel de les restaurer. Les plasmas frais ou congelé sont ici de rigueur. Si l’hématocrite de l’animal est en dessous de 25 %, il est nécessaire de lui apporter du sang frais. Enfin, si l’albuminémie est supérieure à 20 g/L et l’hématocrite supérieur à 25 %, les colloïdes de synthèse peuvent être utilisés [6,11,13,17-20].
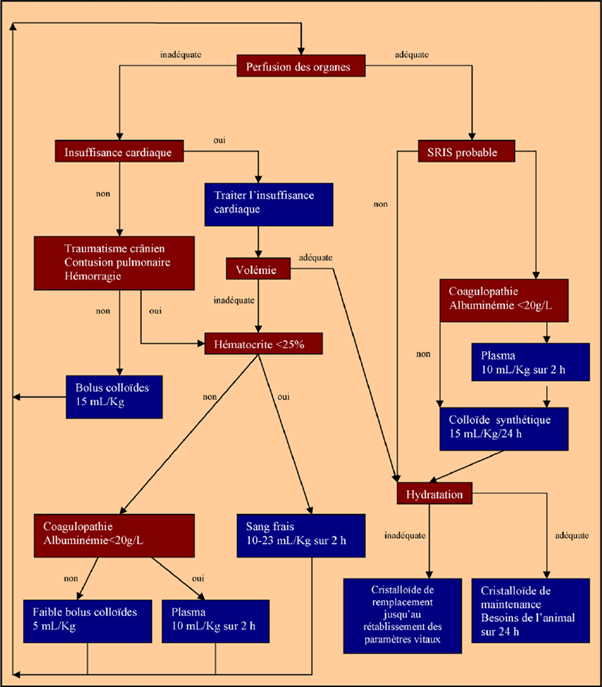
Quel volume, à quelle vitesse ?
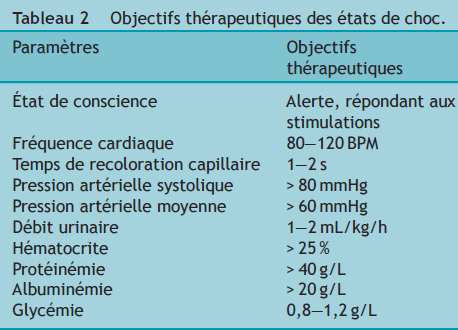
Le type de produit choisi, il reste à déterminer la quantité à apporter ainsi que la vitesse d’administration. L’objectif est de rétablir et de maintenir les constantes vitales dans les intervalles de valeurs usuelles. Pour cela, il est nécessaire de s’appuyer sur un examen clinique minutieux. Le Tableau 2 présente les principaux paramètres à évaluer et leur valeur cibles [13,19]. La démarche consiste à administrer le ou les fluides le plus rapidement possible, à effet, jusqu’à ce que les objectifs soient atteints. Des doses maximales ont cependant été définies. La quantité de cristalloïdes isotoniques administrée ne doit pas dépasser 90 mL/kg. Pour s’assurer une certaine sécurité, il peut être conseillé d’administrer les cristalloïdes par bolus successifs de 15—20 mL/kg [2,4,13,20].
Les colloïdes de synthèse sont administrés par bolus de 15 à 20 mL/kg, toujours associés à des cristalloïdes isotoniques. La dose maximale est de 40 mL/kg par 24 heures [2,4,13,20]. Les solutions hypertoniques ainsi que les mélanges de colloïdes de synthèse et d’hypertonique sont administrées jusqu’à un maximum de 4 mL/kg à une vitesse de 1 mL/kg par minute. Leur administration doit, elle aussi, toujours être associée à un bolus de cristalloïde isotonique [2,4,6,13-14]. Il est indispensable de garder à l’esprit que les paramètres cardiovasculaire, mesurés ne reflètent pas que la perfusion des organes. Une hypoxémie, une anémie, une hypothermie ou encore la douleur peuvent provoquer une tachycardie et une vasoconstriction. La fluidothérapie lors d’état de choc ne peut donc pas être dissociée de l’oxygénothérapie et de l’analgésie.
Si les commémoratifs, l’anamnèse et l’examen clinique mettent en évidence une cardiopathie, une hémorragie, des lésions pulmonaires ou une hypertension intracrânienne, les doses utilisées sont plus faibles car la surcharge du système cardiovasculaire peut être fatale au chien [2,20,21].
L’objectif est alors de traiter l’affection mettant la vie de l’animal en danger : baisse de la pression intracrânienne, contrôle des arythmies, arrêt des saignements. . .
Il est alors conseillé d’utiliser une réanimation de faibles volumes (small volume resuscitation). À titre d’exemple, on peut s’appuyer sur l’administration de bolus de 5 mL/kg de colloïdes de synthèse associés à 5 mL/kg de cristalloïdes. L’administration des fluides se fait à effet de manière à restaurer et/ou maintenir les constantes vitales [13,20,21].
D’autres alternatives sont possibles, comme les fluidothérapies hypotensives retardées ou permissives (delayed ou permissive hypotensive fluid resuscitation) [21]. Il est cependant difficile de les mettre en place dans nos structures car elles nécessitent une évaluation permanente de la pression artérielle moyenne.
La quantité de sang à transfuser est comprise entre 10 et 23 mL/kg et s’administre sur un maximum de quatre heures.
La dose de plasma à administrer est de 10 mL/kg sur un maximum de quatre heures [13,17,18,20].
Conclusion
L’état de choc est une entité complexe qui, quelle que soit sa composante majeure (hypovolémique, cardiogénique, hypoxique ou cytocellulaire), nécessite systématiquement la mise en place d’une oxygénothérapie, l’établissement d’un plan d’analgésie efficace et l’administration de fluides.
L’objectif constant est de ramener les paramètres vitaux dans les intervalles de valeurs usuelles. Pour ce faire, il est avant tout indispensable de réaliser un examen clinique rigoureux afin d’essayer de déterminer l’origine de l’état de choc. Une bonne connaissance des propriétés des fluides disponibles permettra ensuite de déterminer le ou les types à administrer ainsi que leur dose.