Une surrénalectomie est indiquée lors d’exérèse carcinologique d’une tumeur surrénalienne (hyperplasie, adénome, adénocarcinome, carcinome métastatique, blastome, phéo-chromocytome) et/ou dans la résolution des complications péritumorales induites (thrombus dans la veine cave caudale, par exemple).
Les complications péri-opératoires sont fréquentes (présentes dans 35 à 100 % des cas) [2, 10, 11, 19].
La mortalité est élevée (comprise entre 19 et 28,6 %) [2, 8, 11, 19, 22].
Enjeux cliniques et environnement péri-opératoire
Les animaux qui subissent une surrénalectomie sont, en général, âgés (âge médian d’environ 11 ans) [2, 11, 19].
Dans une étude portant sur 41 surrénalectomies, 15 % des chiens ont présenté des complications peropératoires et 51 %, des complications postopératoires [19]. Le taux de mortalité péri-opératoire est élevé [2, 10, 11, 19, 22].
Cependant, la médiane de survie après l’intervention chirurgicale est comprise entre 690 et 992 jours [2, 11, 13, 19]. La surrénalectomie est une opération à risque qui, si l’animal y survit, est associée à une durée de vie relativement longue et à une qualité de vie améliorée [2, 10, 19].
Il s’agit d’un acte chirurgical indiqué après un long processus diagnostique. Une étude a montré que la mortalité péri-anesthésique est plus élevée lorsque les interventions sont réalisées de manière non anticipée ou en situation d’urgence [2]. Ces observations ont été confirmées par une équipe qui a étudié spécifiquement la surrénalectomie [11].
Il est donc recommandé d’hospitaliser l’animal la veille de l’intervention afin d’effectuer l’ensemble des préparatifs et de mettre en place les mesures jugées nécessaires (bilans sanguins, héparinothérapie, distribution des rôles de chacun).
En raison de l’incidence des complications, il est conseillé de pratiquer l’acte chirurgical le matin.
Ainsi, la gestion postopératoire immédiate est assurée en journée par une équipe au complet.
Facteurs pronostiques préopératoires
Une étude portant sur 41 surrénalectomies a montré que la mise en évidence d’une faiblesse et/ou d’une léthargie lors de l’examen clinique préanesthésique est associée à une durée de survie plus courte [19]. De même, l’existence d’une thrombocytopénie, d’une hypokaliémie ou d’une augmentation de l’urémie, de l’activité plasmatique en aspartate aminotransférase (Asat) ou du temps de céphaline activée est liée à une durée de vie postopératoire plus courte [19]. Certains auteurs ont montré une corrélation entre la taille de la tumeur surrénalienne et la probabilité de mourir pendant la période péri-opératoire [13].
Traitement de la dysendocrinie
Le bénéfice de la mise en place d’un traitement préopératoire de l’affection surrénalienne est un dilemme pour le vétérinaire traitant. La problématique est la suivante : un diagnostic de certitude est-il établi ? Si oui, l’animal bénéficierait-il de la mise en place d’un traitement médical préopératoire ? Il serait alors envisagé de traiter un hypercorticisme avec du trilostane, par exemple, ou une éventuelle hypertension artérielle provoquée par un phéochromocytome à l’aide d’un traitement antihypertenseur (la phénoxybenzamine).
Il n’existe pas, à ce jour, d’examen complémentaire préopératoire valide permettant d’identifier avec une spécificité et une sensibilité satisfaisantes le type de tumeur surrénalienne. Le clinicien établit donc une hypothèse diagnostique (hyperplasie, adénome, adénocarcinome, carcinome métastatique, blastome, phéochromocytome) en s’appuyant sur les données anamnestiques, les commémoratifs, l’examen clinique, ainsi que sur les résultats des examens complémentaires [2, 22]. L’utilisation du trilostane ou de la phénoxybenzamine découle de cette hypothèse diagnostique. Plusieurs études mettent en lumière le manque de sensibilité de cette démarche :
- quatre essais récents ont montré que la nature histologique de la tumeur (adénome, adénocarcinome, phéochromocytome), déterminée par une analyse histopathologique postchirurgicale, n’est pas corrélée au pronostic [5, 10, 11, 19];
- Schwartz et coll. ont mis en évidence que l’administration d’un traitement, quelle que soit sa nature, avant l’intervention chirurgicale n’est pas corrélée à la survie des animaux. Ils ont également suspecté un phéochromocytome chez 2 chiens qui ont reçu un traitement de phénoxybenzamine avant l’opération. Chez ces derniers, les examens histopathologiques ont infirmé l’hypothèse diagnostique [19] ;
- plusieurs équipes ont diagnostiqué des phéochromocytomes par des analyses histopathologiques. Aucun ne l’avait été avant l’acte chirurgical. Les animaux n’ont donc pas reçu de traitement spécifique [11, 13, 19] ;
- Anderson et coll. ont identifié une hypertension systémique préopératoire chez 2 chiens. Les animaux étaient indemnes de phéochromocytome et aucun traitement spécifique n’a été instauré [2].
À ce jour, aucune étude probante ne permet de recommander la mise en place systématique d’un traitement spécifique vis-à-vis d’une affection surrénalienne avant son traitement chirurgical.
Gestion peropératoire
Protocole anesthésique
Aucun essai n’a mis en évidence la supériorité d’un protocole anesthésique par rapport à un autre lors de surrénalectomie. Les recommandations actuelles s’appuient sur des études globales, ne portant pas uniquement sur cette intervention chirurgicale. Ces travaux ont permis, entre autres, d’établir certaines bonnes pratiques anesthésiques vétérinaires qu’il semble judicieux de recommander lorsqu’une surrénalectomie est réalisée [3].
La plupart des protocoles anesthésiques dépriment les fonctions respiratoire et cardiovasculaire. Cela peut se traduire par une diminution de la fréquence respiratoire, pouvant aller jusqu’à une apnée, et une baisse de la pression artérielle en oxygène (PaO2) [1, 6, 18].
Une étude portant sur des chiens sains anesthésiés au propofol a révélé que la désaturation du sang en oxygène intervient plus tardivement que s’ils avaient été préoxygénés à l’aide d’un masque pendant 3 minutes [15]. Ainsi, il peut être recommandé de préoxygéner l’animal avant d’induire l’anesthésie. Les protocoles anesthésiques utilisant un agent de prémédication, quel qu’il soit, suivi d’un agent d’induction (propofol [Propovet®] ou thiopental [Nesdonal®]) administré par voie intraveineuse, puis d’un relais d’isoflurane mélangé à de l’oxygène pur sont associés aux plus faibles taux de mortalité en médecine vétérinaire [2].
Protocole analgésique
Comme pour toute laparotomie, la surrénalectomie est un acte douloureux. L’accessibilité réduite oblige l’équipe chirurgicale à pratiquer une incision large, à utiliser des écarteurs et à manipuler les tissus avoisinants (photo 1).
Ces gestes engendrent une souffrance nociceptive sévère à très sévère. Certaines complications comme la pancréatite peuvent aussi être à l’origine de phénomènes algiques intenses.
La mise en place d’un protocole analgésique multimodal est recommandée [5-7]. Celui-ci peut reposer, par exemple, sur l’administration intraveineuse de l’association d’un opioïde (morphine : un bolus de 0,24 mg/kg suivi d’une administration de 0,24 mg/kg/h pendant 6 heures), de kétamine (Clorkétam®, Imalgène®, Kétamine Virbac®) à faible dose (un bolus de 0,5 mg/kg suivi d’une administration de 0,5 mg/kg/h pendant 6 heures) et de lidocaïne (un bolus de 1 mg/kg suivi de 3 mg/kg/h pendant 6 heures) [5-7, 16]. Ce mélange est éventuellement associé à un anti-inflammatoire non stéroïdien (photo 2).
L’apport d’un anesthésique local associé à un morphinique par voie péridurale est envisageable. Il peut se réaliser par l’injection unique d’un mélange de 0,2 ml/kg de bupivacaïne 0,5 % associée à 0,1 mg/kg de morphine dans un volume compris entre 0,2 et 0,26 ml/kg. Le volume maximal ne doit pas dépasser 6 ml. Cette injection unique a une durée d’action estimée à 6 heures [7].
Il est possible d’administrer ce mélange de manière prolongée, aussi longtemps qu’il est jugé nécessaire, en posant un cathéter péridural (photo 3) [21]. La quantité de principe actif à injecter est alors calculée en se fondant sur celle de morphine à administrer. La concentration de la solution de morphine est de 2 mg/ml. La dose nécessaire est de 0,3 mg/kg/24 h. Une fois le volume de morphine calculé, la même quantité de bupivacaïne 0,5 % est ajoutée. Le mélange est alors administré sur 24 heures à l’aide d’un pousse-seringue [9].
Néphrectomie
Une néphrectomie et une hémorragie peropératoire sont les seules complications chirurgicales qui ont été associées à une mortalité péri-opératoire accrue [19].
Présence d’un thrombus
L’invasion de la veine cave caudale par un thrombus a été décrite dans 10 à 25 % des cas [10, 11, 13]. Elle n’était pas corrélée au pronostic immédiat [10, 11, 13]. Cependant, cette absence de corrélation doit être considérée avec prudence car elle a été établie sur des effectifs restreints. Une erreur de type 2 (absence de corrélation entre 2 variables induite par le recrutement d’un effectif trop faible) pourrait, dans le cas présent, induire le clinicien en erreur. Une équipe a montré que la médiane de survie des animaux atteints d’une thrombose veineuse est plus faible que celle des individus qui en sont indemnes [13].
Soins postopératoires
Traitement général
Dans un premier temps, les soins postopératoires ne sont pas spécifiques. En raison des taux élevés de morbidité et de mortalité, il est recommandé de considérer tous les animaux qui ont subi une surrénalectomie comme des individus dont l’état est critique. Le soutien des fonctions respiratoire et cardiovasculaire, ainsi que l’analgésie sont prioritaires [17].
Une étude portant sur des chiennes saines qui ont subi une ovariohystérectomie a montré que la supplémentation en oxygène pendant les 2 heures qui suivent l’intervention à l’aide d’une sonde nasale permet d’améliorer la saturation tissulaire en oxygène [20]. Une autre équipe a recherché l’influence du décubitus chez des chiens ne recevant pas de supplémentation en oxygène dans une unité de soins intensifs. Les animaux placés en décubitus sternal ont présenté une PaO2 supérieure à celle des individus en décubitus latéral [14]. Ainsi, il peut être conseillé de supplémenter l’animal en oxygène à l’aide d’une sonde nasale et de le positionner en décubitus sternal (photo 4).
Le soutien de la fonction cardiovasculaire est assuré par la mise en place d’un plan de fluidothérapie rigoureux.
L’analgésie multimodale est poursuivie aussi longtemps que nécessaire [5, 6]. Une réalimentation précoce est recommandée [4].
Traitement spécifique
La spécificité des soins postopératoires intervient dans la recherche des complications. Selon les auteurs, entre 35 et 51% des animaux présentent des complications postopératoires. Les plus communes sont l’insuffisance surrénalienne transitoire, la thrombo-embolie pulmonaire, la pancréatite, l’insuffisance rénale aiguë, la péritonite, l’hypotension et la bradycardie [2, 11, 13, 22].
Seules la pancréatite et l’insuffisance rénale aiguë ont été associées à une réduction franche de la médiane de survie (7 jours). Les animaux ne présentant ni pancréatite, ni insuffisance rénale aiguë ont une médiane de survie de 908 jours [19].
L’exérèse d’une glande surrénale suscite, en général, la crainte d’une insuffisance cortico-surrénalienne postopératoire transitoire. Certains auteurs administrent des glucocorticoïdes au cours de l’hospitalisation [8, 10, 19, 22].
À la lumière des études publiées, une complémentation systématique en corticoïdes ne semble pas justifiée. Une approche pourrait consister à tester le fonctionnement de l’axe corticotrope par un test de stimulation à l’adrénocorticotrophine (ACTH) dans la période postopératoire immédiate, aux 7e et 14e jours, ainsi qu’en cas de suspicion clinique d’insuffisance surrénalienne. Cela pourrait permettre d’ajuster au mieux une thérapeutique substitutive.
La surrénalectomie est une opération souvent associée à la survenue de thrombo-embolies pulmonaires [2, 19, 22]. Une revue récente sur la prévention et les traitements des thrombo-embolies chez l’animal de compagnie recommande l’administration d’héparine de haut poids moléculaire [12]. Du plasma hépariné (35 UI/kg) est donné à l’induction de l’anesthésie, suivi de deux injections par voie sous-cutanée de 35 UI/kg espacées de 8 heures. Le lendemain de l’intervention chirurgicale, 25 UI/kg sont administrées par voie sous-cutanée toutes les 8 heures.
La dose d’héparine est ensuite progressivement réduite et le traitement est arrêté au 5e jour (figure).
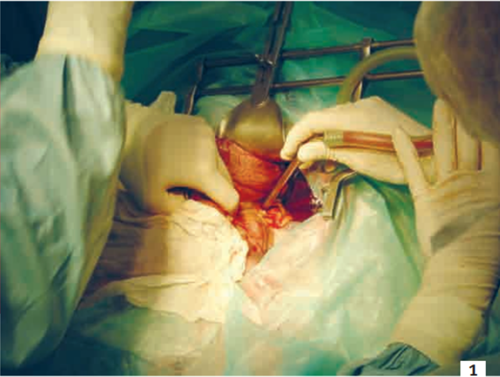
Photo 1 - Vue peropératoire d’une surrénalectomie gauche chez un chien.
Noter la taille de l’incision, la présence d’un écarteur et la manipulation des tissus mous, sources de douleur pour l’animal.
Photo : C. Bille

Photo 2 - Association de pousse-seringues permettant un protocole d’analgésie multimodale.
Il s’agit ici d’une administration simultanée de fentanyl, de kétamine et de lidocaïne via les trois premiers pousse-seringues
Photo : C. Bille
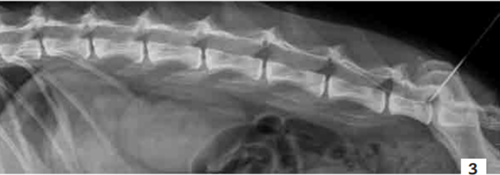
Photo 3 - Cliché radiographique de profil de la colonne lombaire d’un chien.
Noter le cathéter péridural qui permet de compléter le protocole analgésique avec un anesthésique local associé à un morphinique par voie péridurale.
Photo : C. Bille
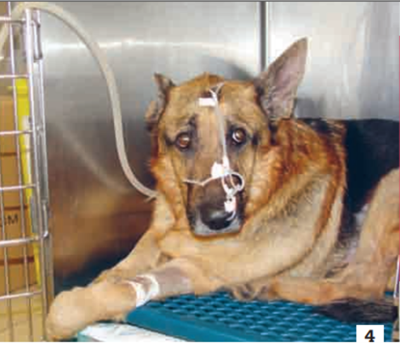
Photo 4 - Oxygénation postopératoire chez un chien assurée grâce à une lunette à oxygène.
Photo : C. Bille

Figure - Protocole de thromboprophylaxie utilisant de l'héparine de haut poids moléculaire
IV : intraveineuse ; SC : voie sous-cutanée.
D’après [12]
Conclusion
La surrénalectomie est un acte chirurgical risqué. Elle est associée à un taux de complications péri-opératoires compris entre 35 % et 50 % et à une mortalité péri-opératoire d’environ 20 %. Néanmoins, les animaux qui survivent à cette intervention présentent une médiane de survie importante d’environ 700 jours.
Une prise en charge rigoureuse permet d’identifier les facteurs pronostiques péjoratifs (faiblesse, léthargie, thrombocytopénie, augmentation de l’urémie, de l’activité plasmatique en Asat et du temps de céphaline activée, hypokaliémie, hémorragie, néphrectomie associée). Elle permet aussi de déterminer et de gérer précocement les complications les plus fréquemment rencontrées (insuffisance surrénalienne relative, thrombo-embolie pulmonaire, pancréatite, insuffisance rénale aiguë, péritonite).