La mesure invasive de la pression artérielle chez le chien
La pression artérielle correspond à la pression qu’exerce le sang sur la paroi des artères avec, pour valeur maximale, la pression artérielle systolique, et minimale, la diastolique. La mesure invasive de la pression artérielle est la méthode de référence [1–6].
Elle est obtenue après le placement d’un cathéter dans une artère périphérique relié par un système de tubulures remplies de sérum physiologique hépariné à un capteur. La pression exercée à chaque instant sur le capteur est affichée sur l’écran de contrôle sous forme d’une courbe.
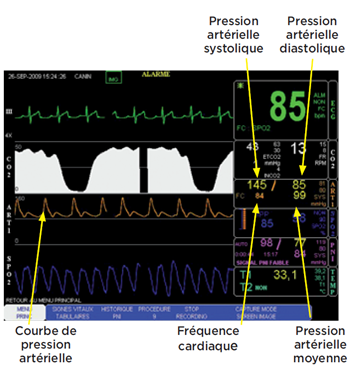
 Les valeurs de pressions artérielles systolique, moyenne et diastolique sont évaluées en permanence.
Les valeurs de pressions artérielles systolique, moyenne et diastolique sont évaluées en permanence.
Cette méthode n’est pas influencée par l’état physiologique du patient (hypo-/normo-/hypertendu).
Le materiel
Le dispositif comprend un capteur. Il est relié d’une part au cathéter artériel par 1 tubulure et 2 robinets 3 voies.
Le 1er robinet 3 voies “A” est placé le plus près possible du capteur. Il permet d’établir la calibration du système avec l’air ambiant à la pression atmosphérique.
Photo 1 - Pose d’un 2e robinet 3 voies “B”
Il est placé le plus près possible du patient. Il permet d’effectuer la purge du système ainsi que des prélèvements sanguins artériels.
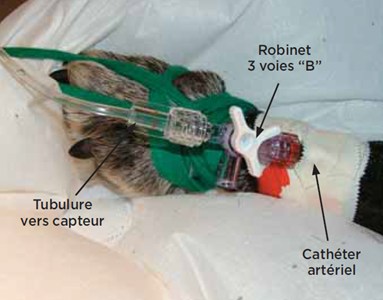
 Photo 2 - Les connexions
Photo 2 - Les connexions
Elles doivent toutes être effectuées avec des connecteurs de type Luer-lock®. L’ensemble du système doit être le plus court et le plus rigide possible pour ne pas fausser la mesure.
D’autre part, le capteur est relié à l’écran multiparamétrique qui possède le logiciel de mesure et d’interprétation des variations de pression.
L’ensemble des tubulures est purgé avec le soluté physiologique hépariné (1 UI/mL) avant d’être utilisé.
L’attention du lecteur est attirée sur le fait qu’aucune bulle d’air ne doit être présente.
Chez les animaux de compagnie, le cathéter artériel peut être posé dans l’artère pédieuse ou dans l’artère auriculaire.
Photo 3 - L’artère pédieuse est utilisée dans cet exemple. L’artère auriculaire peut aussi être utilisée.
L’artère pédieuse est située entre les os métatarsiens II et III. Le pouls est palpé dans cette région et la zone est tondue et préparée avec une solution antiseptique.
La principale contre-indication à la pose d’un cathéter artériel est la présence d’une infection dermatologique sur le lieu de ponction.
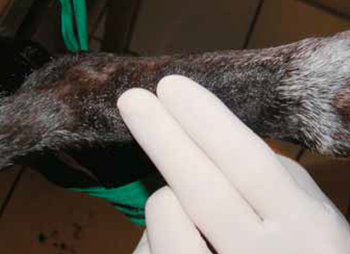
Photo 4 - La pose du cathéter peut être techniquement difficile et longue.
Elle ne peut être envisagée que sur un animal anesthésié.
Face à un patient dont l’état physiologique est dégradé, l’analyse des risques pour celui-ci doit être minutieusement effectuée.
Il ne s’agit pas d’une contre-indication absolue mais le clinicien doit garder à l’esprit que la pose d’un cathéter artériel ne doit pas retarder les manoeuvres de réanimation.
L’artère est cathétérisée de la même manière qu’une veine. Le bon positionnement du cathéter est identifié par le caractère pulsatile du flux sanguin ainsi que la couleur rouge vif du sang artériel.
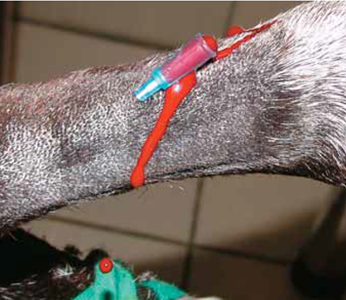
Photo 5 - Un bouchon vissé est mis en place.
L’utilisation du bouchon fourni avec le cathéter est déconseillée car la puissance du flux artériel le délogera.
Le matériel est fixé avec du ruban adhésif.
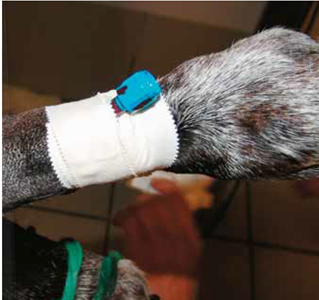
Photo 6
Le système de tubulure, relié au capteur, est vissé au cathéter artériel qui est purgé manuellement.
À ce stade, la mise en place du système de mesure invasive de la pression artérielle est terminée.
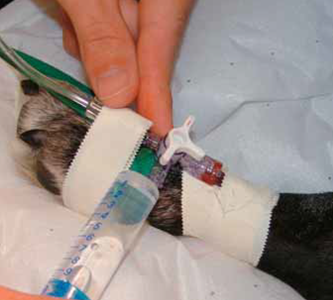
Photo 7 - Calibration
L’écran multiparamétrique l’indique en affichant “zéro PI requis” : le capteur est fixé à la même hauteur que l’atrium droit de l’animal.
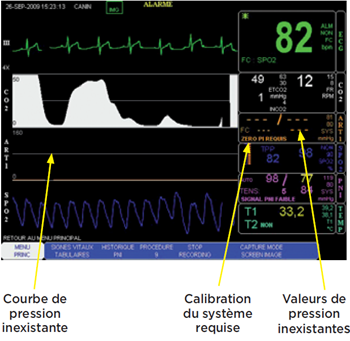
Photo 8
Le robinet 3 voies le plus proche du capteur est tourné de manière à être en continuité avec l’air ambiant.
La pression exercée par l’air à la pression atmosphérique sur l’interface air/eau représente le zéro.
Le moniteur est calibré. Le robinet 3 voies est positionné de manière à remettre en contact le capteur et la colonne d’eau comme sur la photo “matériel nécessaire”.
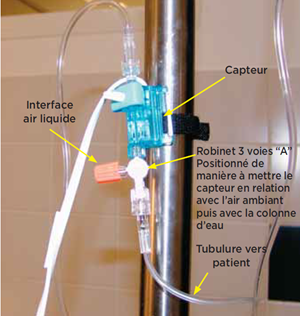
Photo 9
Le moniteur affiche la courbe instantanée de pression artérielle ainsi que les valeurs de la fréquence cardiaque et des pressions systolique, moyenne et diastolique.
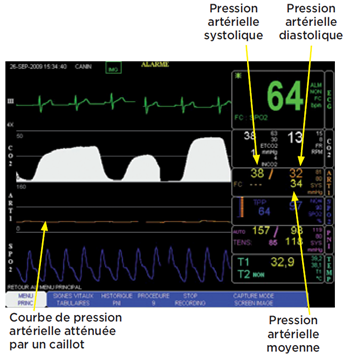
Photo 10
Un aplatissement de la courbe peut être observé lorsque le cathéter s’obstrue. Il est alors recommandé d’effectuer une purge avec du soluté hépariné (1 UI/mL).
Il peut aussi être recommandé d’effectuer une purge continue avec un pousse-seringue réglé à un débit de 2 mL/h. Ce flux ne fausse pas la mesure.
Conclusion
La mesure invasive de la pression artérielle est la méthode de référence. Elle offre à l’anesthésiste un outil fiable, quel que soit l’état hémodynamique du patient.
Le caractère permanent de la mesure permet de diagnostiquer une hypotension immédiatement. Le caractère invasif de la méthode lui confère cependant des risques d’infection, de thrombose, d’embolie et d’hématome.