Adénocarcinome pulmonaire chez une jeune chatte
Une chatte non stérilisée âgée de 3 ans est présentée pour difficultés respiratoires d’apparition aiguë.
L’animal a été adopté 1 mois auparavant et n’a pas accès à l’extérieur.
Un SNAP test FIV/FeLV a été réalisé et est négatif.
Examen clinique
À l’inspection, il est remarqué une dyspnée restrictive (fréquence respiratoire de 64 respirations par minute (rpm)).
Le score corporel est évalué à 2/5. Les muqueuses sont roses et le temps de recoloration capillaire inférieur à 2 secondes. La palpation montre un pouls artériel fémoral modérément frappé mais synchrone avec les battements cardiaques ainsi qu’un choc précordial normal.
La température rectale est de 38,9 °C. L’auscultation révèle une atténuation des bruits cardiaques, une tachycardie régulière (fréquence cardiaque > 200 battements par minute (bpm)) sans souffle audible ainsi qu’une augmentation des bruits respiratoires. Le reste de l’examen clinique est normal.
Bilan de l’anamnèse et de l’examen clinique
Il s’agit d’une chatte jeune adulte présentée pour une dyspnée aiguë. L’examen clinique renseigne une dyspnée restrictive, une tachycardie, une atténuation des bruits cardiaques et une discrète hyperthermie.
Hypothèses diagnostiques
L’association d’une dyspnée restrictive et d’une atténuation des bruits cardiaques évoque en premier lieu un épanchement pleural. Une masse médiastinale de grande taille ou une hernie diaphragmatique ou péritonéo-péricardique sont également évoquées.
En raison de la tachycardie, un épanchement pleural cardiogénique est privilégié mais une autre cause (infectieuse par exemple, particulièrement en raison de la discrète hyperthermie) ne peut être exclue 1.
Examens complémentaires
Un examen radiographique thoracique est réalisé (Fig. 1a et 1b) : il montre la présence d’une dilatation modérée des artères pulmonaires plus accentuée dans les lobes crânial droit et caudal gauche ; la silhouette cardiaque est élargie avec un vertebral heart size (VHS) = 9,8 (VU : 7,5 ± 0 3) 2 ; un épanchement pleural modéré associé à un arrondissement des bords pulmonaires responsable d’une opacité interstitielle modérée est mis en évidence. Il est observé une hépatomégalie modérée.
L’ensemble est compatible avec une insuffisance cardiaque responsable d’un épanchement pleural chronique, un arrondissement des bords pulmonaires et secondairement une hépatomégalie suite à la congestion veineuse.
L’examen échographique abdominal est normal.
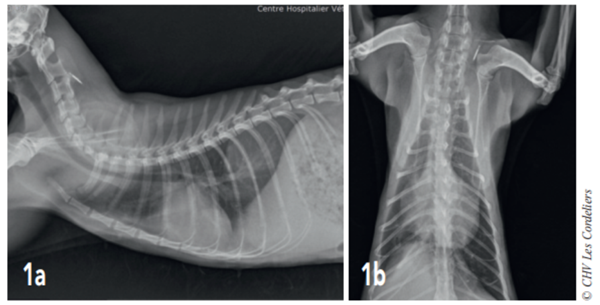 Fig. 1a – Radiographie thoracique de profil droit du 07/08/2017 : cardiomégalie (VHSM 9,8 ; VU : 7,5 ± 0,3 A.L. Lister), dilatation artérielle pulmonaire modérée, consolidation du lobe pulmonaire moyen droit et épanchement pleural modéré.
Fig. 1a – Radiographie thoracique de profil droit du 07/08/2017 : cardiomégalie (VHSM 9,8 ; VU : 7,5 ± 0,3 A.L. Lister), dilatation artérielle pulmonaire modérée, consolidation du lobe pulmonaire moyen droit et épanchement pleural modéré.
Fig. 1b – Radiographie thoracique de face du 07/08/2017 : cardiomégalie (silhouettecardiaque > 2/3 de la largeur thoracique), dilatation artérielle pulmonairemodérée,consolidation du lobe pulmonaire moyen droit et épanchement pleural modéré.
L’examen échocardiographique transthoracique montre la présence d’une dilatation biatriale importante sans hypertrophie ou dilatation des ventricules.
Le mode Doppler pulsé révèle une diminution du temps de relaxation isovolumique, un rapport E/A mitral égal à 2,8, compatibles avec un profil restrictif.
L’examen biochimique sanguin, l’ionogramme et la numération et formule sanguines montrent
- une leucocytose (26,52 x 109/l ; VU : 2,87 – 17,02 x 109/l ) neutrophilique (20,05 x 109/l ;VU : 1,48 – 10,29 x 109/l),
- une anémie régénérative (Hb = 6,4 g/l (VU : 9,8 – 16,2 g/l) ; Htc = 18,3 % (VU : 30,3 – 52,3 %) ; réticulocytes = 100,5 K/µl (VU : 3,0 – 50,0 K/µl)),
- une protéinémie dans les limites hautes (84 g/l ; VU : 57 – 89 g/l) et une hyperglobulinémie (62 g/l ; VU : 28 – 51 g/l) avec un rapport albumine/globuline égal à 0,4.
La thoracocentèse diagnostique révèle un exsudat sérohémorragique (densité par réfractométrie : 1,032 ; taux de protéines=54g/l).
L’examen cytologique du liquide d’épanchement montre la présence de nombreux polymorphonucléaires neutrophiles et d’hématies sans germe intracellulaire ni cellule tumorale suspecte visibles : soit un exsudat.
L’examen bactériologique permet l’identification de Bordetella bronchiseptica sensible à l’association amoxicilline/acide clavulanique.
Les PCR recherchant le coronavirus de la péritonite infectieuse féline et des mycobactéries sont négatives. Les résultats des examens complémentaires sont en faveur d’un pyothorax infectieux, d’une myocardiopathie (forme restrictive ou myocardite dans le contexte clinique, pouvant participer à la formation de l’épanchement pleural par insuffisance cardiaque congestive) 3 et d’une lésion pulmonaire caudodorsale dont l’origine (infectieuse, tumorale) reste à déterminer 1, 4, 5, 6, 7, 8.
Traitement et suivi
L’animal est hospitalisé avec fluidothérapie, antibiothérapie (amoxicilline/acide clavulanique à 12,5 mg/kg BID) et un traitement diurétique (furosémide : 1 mg/kg toutes les 4 heures).
Une sortie est envisagée 3 jours plus tard avec le traitement suivant : Clavaseptin® 16,13 mg/kg PO BID pendant 4 semaines, Libeo® 2,42 mg/kg/jour PO en 3 prises à dose dégressive jusqu’au contrôle.
La surveillance de la fréquence respiratoire à domicile est conseillée avec un contrôle clinique 3 semaines plus tard (Tab. 1).
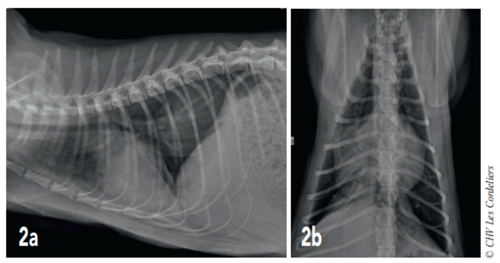 Fig. 2a – Radiographie thoracique de profil droit du02/09/2017 (J+21 jours) : cardiomégalie (VHSM 9,5 ; VU : 7, 5 ± 0,3 A.L. Lister), épanchement pleural et consolidation du lobe moyen droit.
Fig. 2a – Radiographie thoracique de profil droit du02/09/2017 (J+21 jours) : cardiomégalie (VHSM 9,5 ; VU : 7, 5 ± 0,3 A.L. Lister), épanchement pleural et consolidation du lobe moyen droit.
Fig. 2b – Radiographie thoracique de face du 02/09/2017 (J+21 jours) : cardiomégalie (silhouette cardiaque > 2/3 de la largeur thoracique), épanchement pleural (scissure pleurale) et consolidation du lobe moyen droit
J+21 jours : le chat est en bon état général mais présente des épisodes de dyspnée (FR : 40-44 rpm). Les radiographies (Fig. 2a et 2b) montrent une cardiomégalie (VHS = 9,5) avec un épanchement pleural (scissure interlobaire) et une consolidation du lobe pulmonaire moyen droit : ces images sont compatibles avec une atélectasie pulmonaire ne permettant pas d’exclure un processus néoplasique ; la vascularisation artérielle pulmonaire est dans les normes.
L’examen échocardiographique révèle une normalisation de la taille des atria et une amélioration de la dysfonction diastolique.
L’antibiothérapie est poursuivie 3 semaines de plus et le furosémide arrêté progressivement.
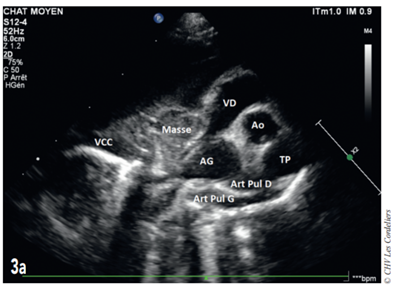 Fig. 3a – Échocardiographie du 23/09/2017 (J+42 jours) : mise en évidence d’une masse hétérogène comprimant la veine cave caudale (VCC) et l’atrium droit (AD) ; AG (atrium gauche) ; Ao (aorte) ; Art Pul D (artère pulmonaire droite) ; Art Pul G (artère pulmonaire gauche) ; TP (tronc pulmonaire) ; VD (ventricule droit).
Fig. 3a – Échocardiographie du 23/09/2017 (J+42 jours) : mise en évidence d’une masse hétérogène comprimant la veine cave caudale (VCC) et l’atrium droit (AD) ; AG (atrium gauche) ; Ao (aorte) ; Art Pul D (artère pulmonaire droite) ; Art Pul G (artère pulmonaire gauche) ; TP (tronc pulmonaire) ; VD (ventricule droit).
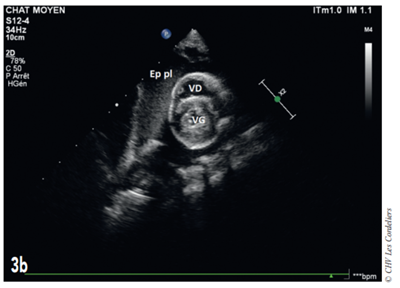 Fig. 3b – Échocardiographie du 23/09/2017 (J+42 jours) : mise en évidence d’un épanchement pleural (Ep pl) ; VG (ventricule gauche) ; VD (ventricule droit).
Fig. 3b – Échocardiographie du 23/09/2017 (J+42 jours) : mise en évidence d’un épanchement pleural (Ep pl) ; VG (ventricule gauche) ; VD (ventricule droit).
J+42 jours : malgré le bon état général, la dyspnée persiste. L’échocardiographie (Fig. 3a et 3b) montre une masse pulmonaire maintenant cavitaire s’étendant jusque dans le médiastin crânial et associé à un épanchement pleural.
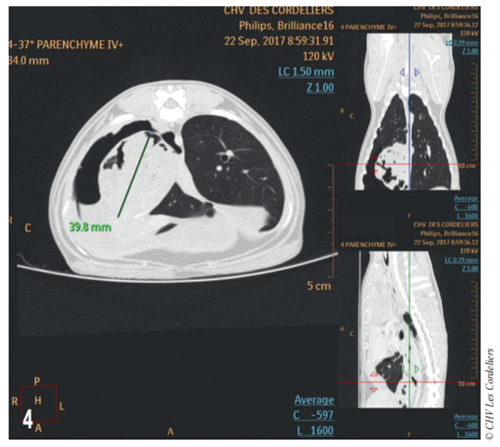 Fig. 4 – Examen tomodensitométrique du 23/09/2017 : mise en évidence d’une masse cavitaire de 39,8 mm de diamètre dans le médiastin crânial droit.
Fig. 4 – Examen tomodensitométrique du 23/09/2017 : mise en évidence d’une masse cavitaire de 39,8 mm de diamètre dans le médiastin crânial droit.
Un examen tomodensitométrique thoracique (Fig. 4) met en évidence un remaniement important du lobe caudal droit avec présence d’un pneumothorax et d’une pleurésie associé à une hypertrophie du ganglion bronchique ; il est constaté la présence d’un tissu anormal contre le péricarde dans l’hémithorax droit et dans le médiastin.
Une chirurgie par sternotomie permet l’excision d’un tissu pyogranulomateux de l’hémithorax droit avec complète hépatisation du lobe caudal droit lobectomisé avant pose d’un drain thoracique,retiré après 72 heures. L’antibiothérapie est continuée au moyen de Clavaseptin® 16,13 mg/kg BID (10 jours) et de Metrobactin® 62,5 mg/kg en une prise (3 semaines).
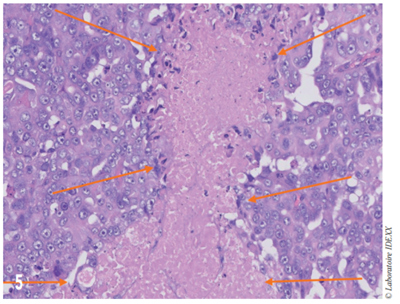 Fig. 5 – Adénocarcinomatose associée à une importante plage de nécrose (encadrée par les flèches orange).
Fig. 5 – Adénocarcinomatose associée à une importante plage de nécrose (encadrée par les flèches orange).
L’examen histologique du tissu (Fig. 5) met en évidence un a dénocarcinome trabéculaire peu différencié largement nécrotique remanié de forte malignité avec envahissement du ganglion bronchique traduisant un pronostic réservé 1, 7, 9, 10.
Dix jours après l’intervention, l’épanchement pleural récidive. Une thoracocentèse permet le retrait de 115 ml de liquide hémorragique. Un processus tumoral épithélial pulmonaire de haut grade très probablement d’origine primaire est confirmé.
En attente de la décision d’une chimiothérapie, un traitement corticoïde (Dermipred® 1,61 mg/kg/jour) est mis en place pour limiter la recollection de l’épanchement. Un protocole chimiothérapeutique est mis en place par instillation intrapleurale directe de carboplatine à 250 mg/m² et poursuite du traitement corticoïde (Dermipred® 1,61 mg/kg/jour) pour limiter l’épanchement pleural et contrôler la prolifération tumorale.
Une seconde administration de carboplatine est envisagée 3 semaines plus tard, malheureusement la masse continue à augmenter de volume et est à l’origine d’une tamponnade cardiaque, soulagée par ponction (Fig. 6a et 6b) ; après récidive de la tamponnade l’euthanasie est décidée à J+97 jours.
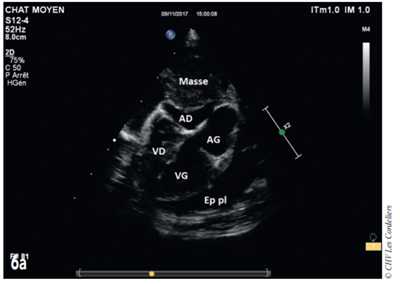 Fig. 6a – Échocardiographie du 06/11/2017(J+91jours): masse médiastinale crâniale comprimant l’atrium droit (AD) ; on constate également la présence d’un épanchement pleural récidivant (Ep pl) ; AG (atrium gauche) ; VD (ventricule droit) ; VG (ventricule gauche)
Fig. 6a – Échocardiographie du 06/11/2017(J+91jours): masse médiastinale crâniale comprimant l’atrium droit (AD) ; on constate également la présence d’un épanchement pleural récidivant (Ep pl) ; AG (atrium gauche) ; VD (ventricule droit) ; VG (ventricule gauche)
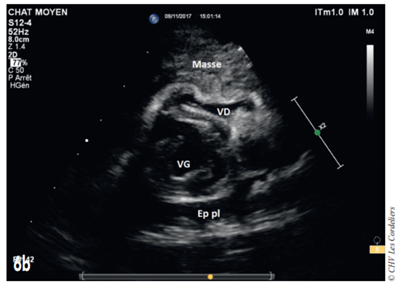 Fig. 6b – Échocardiographie du 06/11/2017 (J+91 jours) : masse médiastinale crâniale comprimant le ventricule droit (VD) et provoquant une tamponnade cardiaque par compression ; on constate également la présence d’un épanchement pleural récidivant (Ep pl) ; VG (ventricule gauche).
Fig. 6b – Échocardiographie du 06/11/2017 (J+91 jours) : masse médiastinale crâniale comprimant le ventricule droit (VD) et provoquant une tamponnade cardiaque par compression ; on constate également la présence d’un épanchement pleural récidivant (Ep pl) ; VG (ventricule gauche).