Traitement par la pose d’un pacemaker
Le bloc atrio-ventriculaire (BAV) est un trouble de la conduction électrique localisé au nœud atrio-ventriculaire et/ou au système His-Purkinje.
À partir du degré 2, il s’agit d’une indication à la pose d’un pacemaker.
Nous indiquons, à l’occasion de la présentation de ce cas clinique, les modalités de la mise en place de ce dispositif.
Orkan est un dogue de Bordeaux mâle entier de 3 mois, présenté en consultation de cardiologie suite à la découverte fortuite d’une bradycardie par le vétérinaire traitant, sans signe clinique associé. Il est primovacciné et présente comme seul antécédent médical un épisode diarrhéique 15 jours auparavant, résolu avec des traitements symptomatique et antibiotique. Aucune anomalie cardiaque n’était présente à ce moment.
Examen clinique
L’examen général révèle des muqueuses roses et humides, une courbe respiratoire normale et un pouls artériel fémoral frappé et synchrone avec le choc précordial.
L’auscultation cardiaque met en évidence une bradycardie à 60 battements par minute, associée à un souffle systolique apexien droit de grade 3/6 ainsi qu’un souffle diastolique apexien gauche de grade 2/6.
Le reste de l’examen clinique général est normal.
Hypothèses diagnostiques
Plusieurs causes de bradycardie peuvent être envisagées, notamment d’origine cardiaque (malformation congénitale, myocardite, endocardite, dysfonctionnement sinusal), électrolytique (hyperkaliémie, hypocalcémie), endocrinienne (hypothyroïdie), médicamenteux (bétabloquants, cimétidine, a2-agonistes, acépromazine, digitaliques) ou encore secondaire à une augmentation du tonus vagal (hypertension intracrânienne, affection laryngée ou pharyngée, compression des artères carotides, affections gastriques).
L’absence d’accès à un toxique permet d’exclure les causes médicamenteuses.
Le souffle systolique apexien droit est le reflet d’une insuffisance tricuspidienne (dysplasie tricuspidienne, endocardite, fibrose valvulaire, hypertension artérielle pulmonaire), tandis que le souffle diastolique apexien gauche traduit une anomalie d’origine fonctionnelle ou lésionnelle.
Examens complémentaires
Afin d’explorer la bradycardie, un électrocardiogramme est réalisé (Fig. 1) et révèle la présence d’un rythme non sinusal et non régulier. Quelques complexes QRS normaux sont visualisés, suivis de plusieurs complexes d’échappement de type hissien et non précédés d’une onde P.
Par ailleurs, de nombreuses ondes Pne sont pas conduites.
Un bloc atrio-ventriculaire de degré 2 de haut grade avec échappement hissien est diagnostiqué.
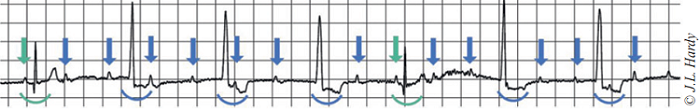
Fig 1 – Électrocardiogramme : les flèches vertes indiquent les ondes P conduites, suivies par un complexe QRS normal (arc vert). Les flèches bleues indiquent les ondes P non conduites. Les arcs bleus indiquent les complexes d’échappement hissien
Dans le but d’explorer l’origine des souffles entendus à l’auscultation, une échocardiographie est effectuée. Une fuite tricuspidienne est visualisée en systole (Fig. 2A), avec une vitesse maximale à 2,25 m/s, à chaque contraction ventriculaire. Par ailleurs, une discrète asymétrie de la valve tricuspide est visualisée, ce qui laisse suspecter en première intention une dysplasie tricuspidienne. Un reflux mitral est également mis en évidence en diastole, lors d’expression du bloc atrioventriculaire (Fig. 2B)
.png)
.png)
Fig. 2A et 2B – Échocardiographie en Doppler pulsé sur la valve tricuspide (2A) et sur la valve mitrale (2B). Les flèches blanches indiquent les fuites. La lettre A correspond à l’onde A, la lettre E correspond à l’onde E
Un bilan biologique complet est réalisé et permet d’exclure toutes autres causes métaboliques, ainsi que les causes inflammatoires et infectieuses cardiaques. La troponineI est dosée et permet d’exclure une myocardite active.
Diagnostic
Une dysplasie tricuspidienne associée à un bloc atrioventriculaire de degré 2 (BAV2) responsable de la bradycardie est diagnostiquée.
Traitement de première intention
Le traitement de choix pour un BAV2 est la pose d’un stimulateur cardiaque (pacemaker). Néanmoins, Orkan, jeune dogue de Bordeaux de 10 kg, pourrait potentiellement multiplier son poids par cinq au cours de sa croissance. Pour cette raison, il a été décidé de mettre en place un traitement médical en première intention, avec de la théophylline (Theostat LP® NDH) à la dose de 9 mg/kg une fois par jour, pour son action cardiaque chronotrope positif (Warot, 2002).
Suivi
Lors des suivis, les propriétaires ne rapportent pas d’évolution clinique. La fréquence cardiaque est restée stable entre 50 et 60 battements par minute. Les électrocardiogrammes de contrôle ont montré une amélioration du BAV avec seulement une onde P sur deux non conduite, et aucun complexe d’échappement (Fig. 3A), pendant 6 mois : il s’agit d’un BAV2 1-1. Les échocardiographies ont par ailleurs révélé une persistance des fuites tricuspidienne et mitrale.
Au bout de 9 mois après l’initiation du traitement médical, une dégradation du BAV est notée. L’électrocardiogramme révèle une majorité de complexes d’échappement ventriculaires, de nombreuses ondes P non conduites, et des complexes QRS normaux rares (Fig. 3B). À ce stade, un traitement chirurgical par la pose d’un pacemaker est nécessaire.
.png)
Fig 3A et 3B – Électrocardiogrammes de suivi (avant 6 mois : 3A – à partir de 9 mois : 3B) : les flèches vertes indiquent les ondes P suivies de complexes QRS normaux (arcs verts). Les flèches bleues indiquent les ondes P non conduites. Les arcs bleus indiquent les complexes d’échappement ventriculaire.
Traitement chirurgical
La prémédication et l’induction ont été réalisées avec de la morphine à 0,1mg/kg, du midazolam à 0,2mg/kg et du propofol à 2 mg/kg.
Un pacemaker est mis en place par voie transdiaphragmatique. Il est constitué d’une électrode monopolaire fixée à l’apex du cœur (en regard du ventricule droit), ainsi que d’un générateur disposé dans une loge sous le muscle oblique interne du côté gauche de la plaie de la parotomie (Fig. 4A et 4B).
Le pacemaker est réglé à une fréquence cardiaque minimale de 60 battements par minute la nuit ou de 80 battements par minute le jour, asservi à 130 battements par minute. Ces réglages permettent une durée estimée à 9 ans et 7 mois pour un potentiel électrique de 3V et une durée d’impulsion de 0,4 ms.
Le traitement à la théophylline est cessé puisqu’aucune action chronotrope n’est nécessaire. De la spironolactone (Prilactone Next 100 mg® NDV) à la dose de 2 mg/kg une fois par jour a également été ajoutée pour son effet antifibrosant, après avoir visualisé une discrète augmentation de la taille des cavités cardiaques.
.png)
-postoperatoires.png)
Fig 4A et 4B – Radiographies abdominales profil (A) et face (B) postopératoires.
Suivi postopératoire
Dès la pose du pacemaker, Orkan est plus vif et présente une meilleure forme physique. Il est néanmoins conseillé de maintenir le traitement à base de spironolactone. Les contrôles cliniques, échographiques et électrocardiographiques sont identiques à 1 et 2 mois postopératoires et confirment le bon fonctionnement du pacemaker caractérisé par un complexe de capture de morphologie droite à chaque stimulation électrique (spike) (Fig. 5). La morphologie à droite des complexes de capture est secondaire à l’implantation à droite de l’électrode du pacemaker.
À ce jour, Orkan supporte très bien le pacemaker. Le traitement à base de spironolactone est maintenu.