Dérivés nitrés
Les dérivés nitrés sont des vasodilatateurs principalement veineux. Ils permettent de lutter contre les signes congestifs en diminuant la précharge. À forte dose, ils sont aussi vasodilatateurs artériels, en particulier au niveau des artères coronaires, ce qui permet d’améliorer la perfusion myocardique.
Ils sont indiqués lors d’IC aiguë (traitement d’urgence de l’œdème aigu du poumon), lors d’ischémie myocardique et lors d’hypertension artérielle systémique.
Leur métabolisation est rapide, surtout par voie injectable, et leur durée d’action souvent brève. Leur principal effet secondaire est l’hypotension, constatée en début de traitement, surtout lors de fortes doses (traitement de l’urgence) ou lors d’une utilisation prolongée.
Chaque représentant de cette famille possède ses propres propriétés et indications :
le dinitrate d’isosorbide est principalement vasodilatateur veineux. Il est indiqué dans le traitement de l’IC chronique ;
la trinitrine, puissant vasodilatateur veineux, est surtout conseillée dans le traitement de l’urgence de l’œdème pulmonaire aigu. La forme pommade a disparu alors qu’elle était très utilisée en particulier chez le chat. Les formes « spray » sont moins pratiques et d’une efficacité incertaine ;
le nitroprussiate de sodium est un puissant vasodilatateur mixte d’action immédiate et très brève, indiqué dans le traitement d’urgence de l’œdème pulmonaire aigu et de l’hypertension artérielle. C’est un médicament à usage hospitalier car son administration par voie veineuse nécessite un monitoring humain et instrumental très attentif. Il est inscrit sur la liste des médicaments à rescription restreinte et les vétérinaires peuvent l’obtenir directement auprès du laboratoire producteur ;
la molsidomine est principalement un vasodilatateur coronarien. Elle est indiquée dans le traitement de l’ischémie myocardique et utilisée lors d’IC chronique. Elle n’a pas fait l’objet d’étude chez les carnivores.
Pimobendane
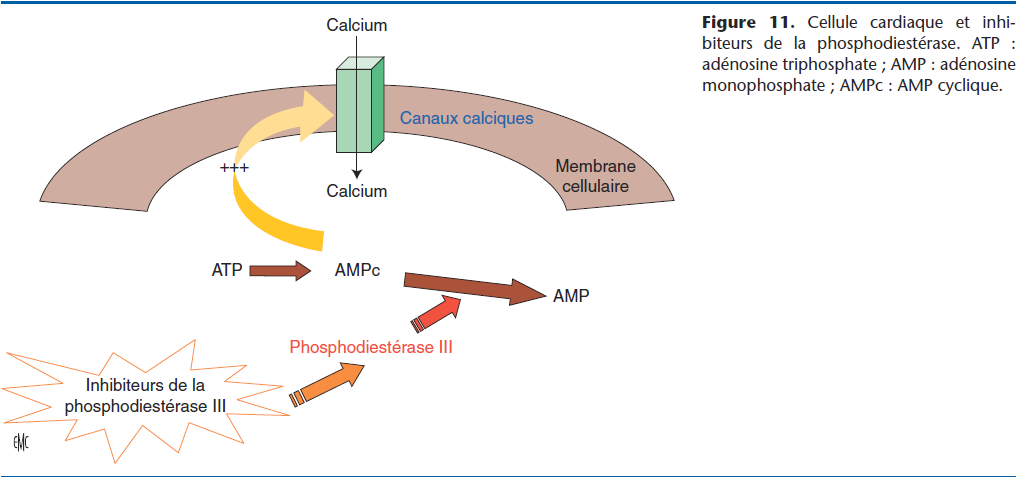
Le pimobendane est un agent inhibiteur des phosphodiestérases de type III et sensibilisateur calcique (Fig. 11). C’est un vasodilatateur systémique artériel, veineux et coronarien. Cette molécule possède également un effet inotrope positif sans augmentation de la concentration intracellulaire de calcium. Il est également lusitrope positif, et permet la diminution de la concentration du tumor necrosis factor alpha et des interleukines 1-bêta et 6 [5].
Ces effets placent le pimobendane parmi les molécules à préconiser pour le traitement de l’IC :
- la vasodilatation artérielle réduit la postcharge systémique et les pressions artérielles pulmonaires. La vasodilatation veineuse diminue la précharge (baisse de la pression veineuse hydrostatique) ;
- la vasodilatation coronarienne entraîne une meilleure oxygénation myocardique ;
- les effets inotropes positifs s’opposent à la chute de contractilité, présente précocement lors de CMD. Lors de maladie valvulaire chronique, il existe également une baisse de contractilité ;
- les effets lusitropes facilitent le remplissage diastolique.
Les effets secondaires potentiels sont des troubles digestifs mineurs dose-dépendants (ramollissement des selles, diarrhée modérée ou vomissements), des troubles rythmologiques d’apparition spontanée dose dépendants, une hypertrophie myocardique à dose élevée surtout lorsque le médicament n’est pas indiqué.
Son utilisation doit s’envisager dès la décompensation de l’IC (stade II classification NYHA, stade II classification ISACHC, stade C classification ACVIM) quelle que soit sa cause.
Lors de CMD, le pimobendane augmente la qualité de vie et la durée de vie d’un facteur 2 à 6 selon des études [4, 6]. Son pouvoir de retarder la décompensation a été prouvée pour la CMD du doberman [7].
Lors de maladie valvulaire mitrale, le pimobendane augmente la qualité de vie en réduisant environ de 30 % la survenue événements indésirables et augmente la durée de vie environ d’un facteur 2 [8]. De fac¸on très récente et sans encore avoir fait l’objet d’une publication, le laboratoire producteur de la molécule princeps du pimobendane annonce les résultats d’une vaste étude clinique montrant que ce médicament a la capacité de retarder la décompensation cardiaque lorsqu’il était prescrit lors de MVD avec remodelage cardiaque. Il sera donc d’un grand intérêt de considérer attentivement les résultats de l’étude EPIC.
Spironolactone
La spironolactone est un antagoniste compétitif de l’aldostérone sur les cellules tubulaires distales (tube contourné distal et tube collecteur). Elle inhibe la réabsorption du sodium et augmente la diurèse. Elle inhibe également la sécrétion des ions hydrogène et potassium dans la lumière tubulaire. Son effet salidiurétique est faible.
L’utilisation de cette molécule dans le traitement de l’IC est surtout liée à ses propriétés antifibrosantes car elle s’oppose aux effets fibrosants de l’aldostérone sur le myocarde, ce qui limite le remodelage et les phénomènes d’apoptoses délétères à terme pour la fonction cardiaque [9].
La spironolactone est indiquée lors de maladie valvulaire mitrale ou de CMD dès la phase de décompensation de l’IC (stade II classification NYHA, stade II classification ISACHC, stade C classification ACVIM). Elle augmente la qualité et la durée de vie. Le principe d’une prescription plus précoce en vue de retarder la décompensation est suggéré par son mécanisme d’action [9].
Antiarythmiques
Ces médicaments sont développés dans un autre article de l’EMC. Ils ne sont pas au sens strict une classe de médicaments de l’IC, mais ils sont très souvent associés à son traitement dans la mesure où les dysrythmies contribuent à la baisse du débit cardiaque. Ils ont, de plus, des propriétés collatérales sur l’inotropisme ou le tonus vasculaire, qui renforce ou au contraire contrarie l’action des autres médicaments de l’IC.
Le panel de médicaments possibles se réduit car de nouvelles techniques de traitement des troubles du rythme sont apparues. Les antiarythmiques fréquemment associés avec les autres classes thérapeutiques sont les suivants.
Digoxine
Hétéroside cardiotonique d’utilisation ancienne et répandue, la digoxine, molécule vagomimétique, ralentit le rythme cardiaque (effet chronotrope négatif) et la vitesse de conduction de l’influx nerveux intracardiaque (effet dromotrope négatif) ; elle augmente l’excitabilité du myocarde (effet bathmotrope positif, ventriculaire surtout), renforce la contractilité (effet inotrope positif) et le tonus du muscle cardiaque (effet tonotrope positif).
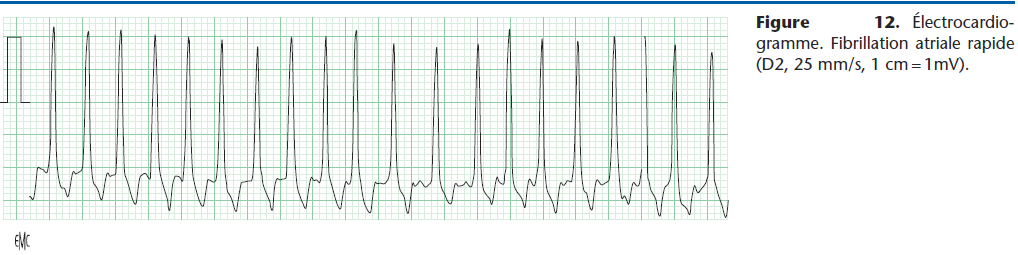
Elle aide à combattre les troubles supraventriculaires, qu’ils soient ou non consécutifs à des lésions de la fibre myocardique : tachycardie sinusale, extrasystolie supraventriculaire, tachycardie jonctionnelle et atriale, et surtout la fibrillation atriale rapide (Fig. 12). Cette dysrythmie très fréquente chez les chiens de grande race atteints de CMD n’est pas réduite par la digoxine, mais celle-ci provoque une diminution sensible de la fréquence cardiaque qui contribue à améliorer le débit cardiaque et l’état clinique de l’animal.
L’efficacité du traitement doit être contrôlée cinq jours au moins après son début.
Ses effets indésirables sont nombreux : troubles digestifs, troubles cardiaques (extrasystoles ventriculaires ou troubles de la conduction). Mais la fréquence de ces effets a beaucoup diminué depuis que la dose a été revue à la baisse : 0,005 à 0,010 mg/kg par jour en deux prises chez le chien et 0,010 mg/kg tous les deux jours chez le chat. La digoxinémie (1,5 à 2 ng/ml) peut être contrôlée pour confirmer un sur- ou sous-dosage.
Diltiazem
Cet inhibiteur calcique a un effet chronotrope négatif, bathmotrope négatif et inotrope négatif peu marqué et tolérable sur un cœur insuffisant.
Ses indications dans les troubles supraventriculaires sont assez similaires à celles de la digoxine (tachycardies supraventriculaires) avec laquelle elle peut être associée ; cette association a prouvé son efficacité pour ralentir la fréquence cardiaque lors de fibrillation atriale rapide [10]. Le diltiazem est généralement bien toléré.
Amiodarone
Les antiarythmiques de classe III prolongent la période réfractaire et créent des conditions défavorables au développement de circuits de réentrée. En comprimé ou sous forme injectable (médicament à prescription restreinte), l’amiodarone s’oppose aux dysrythmies à la fois supraventriculaires et ventriculaires, surtout si elles sont issues d’une réentrée. Des effets indésirables hépatiques (attention chez le doberman) [11] et une mauvaise tolérance par le cœur insuffisant de la forme injectable sont à redouter pour ce médicament dont la posologie est encore mal définie.
Sotalol
C’est un antagoniste non sélectif des récepteurs bêta 1 adrénergiques. Le sotalol commercialisé allonge comme l’amiodarone et les médicaments de la classe III la durée du potentiel d’action et de la période réfractaire du myocarde atrial et ventriculaire, et élève le seuil de déclenchement des fibrillations atriales et ventriculaires. Les propriétés bêtabloquantes du sotalol compléteraient l’effet « classe III » en modulant la stimulation du système nerveux autonome, qui favorise l’émergence des troubles ventriculaires.
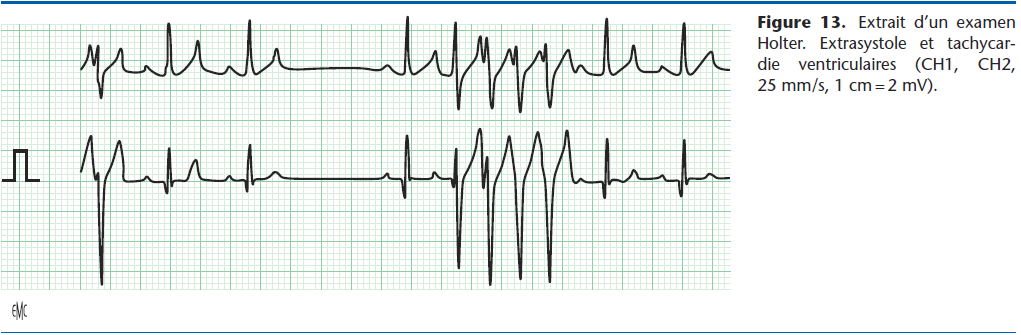
Depuis la disparition de l’aprindine et la mexilétine, le sotalol est devenu le médicament de référence pour traiter ou prévenir les tachycardies ventriculaires [12] (Fig. 13). Il est bien toléré, l’effet inotrope négatif étant moins marqué que celui du propranolol, et les risques de bradycardie et d’effet proarythmogène rares.
Autres médicaments
De nombreuses autres médicaments ont été, sont ou seront prescrits lors d’IC.
Les bêtabloquants utilisés récemment chez l’homme (exemple : carvédidol) ont été à l’origine d’espoirs non confirmés par les études engagées [13].
Le sildénafil est un vasodilatateur efficace pour lutter contre l’hypertension pulmonaire.
Des compléments alimentaires, taurine, carnitine, acides gras insaturés, etc. ont été proposés avec des succès divers pour traiter les cardiopathies responsables d’IC ou l’IC elle-même.
Associations de molécules dans le même médicament
Elles connaissent un véritable essor car elles facilitent grandement l’observance. Leur inconvénient majeur est de ne plus permettre le choix de la dose de leurs composants. Bénazépril et spironolactone sont ainsi associés, et pimobendane et bénazépril, sans qu’une étude clinique ne démontre le bénéfice de cumuler ces deux classes thérapeutiques.
Mise en œuvre des traitements
Le traitement d’un animal insuffisant cardiaque répond à certaines règles qui permettent la mise en œuvre des différentes classes de molécules. Cette mise en œuvre est raisonnée en fonction principalement du stade de l’IC. Bien que déterminant, ce critère n’est pas le seul à prendre en compte. D’autres s’y associent, qui indiquent ou contre-indiquent certaines molécules. En particulier, l’origine de l’IC (maladie causale), la présence de maladies intercurrentes (affections rénale, hypertensive, ostéoarticulaire, tumorale, etc.), les effets secondaires ou indésirables médicamenteux, etc.
Ainsi, la mise en œuvre d’un traitement apparaît de plus en plus « variée ». Chaque animal devient rapidement un cas unique pour lequel le traitement est adapté de fac¸on personnalisée. Les grands principes classiques de cette mise en œuvre se réduisent à des principes de base à partir desquels s’élabore une réflexion pour chaque cas, permettant d’aboutir alors à un choix thérapeutique adapté à l’animal consulté.
Des schémas généraux thérapeutiques de l’IC sont ainsi rédigés dans leurs grandes lignes à partir des classifications précédentes ou à partir des symptômes présentés par l’animal. Les protocoles déjà performants issus de la classification ISACHC (Tableau 4) ont été bouleversés par la nouvelle classification ACVIM, par la parution des recommandations concernant le traitement de la maladie mitrale dégénérative [2], par la mise à disposition de nouveaux médicaments ou de nouvelles indications pour les médicaments existants (Tableau 5).
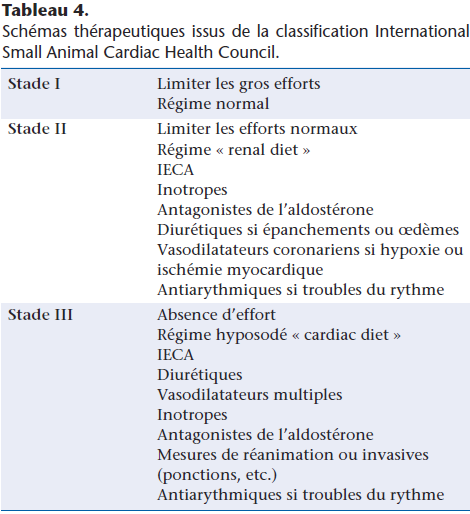
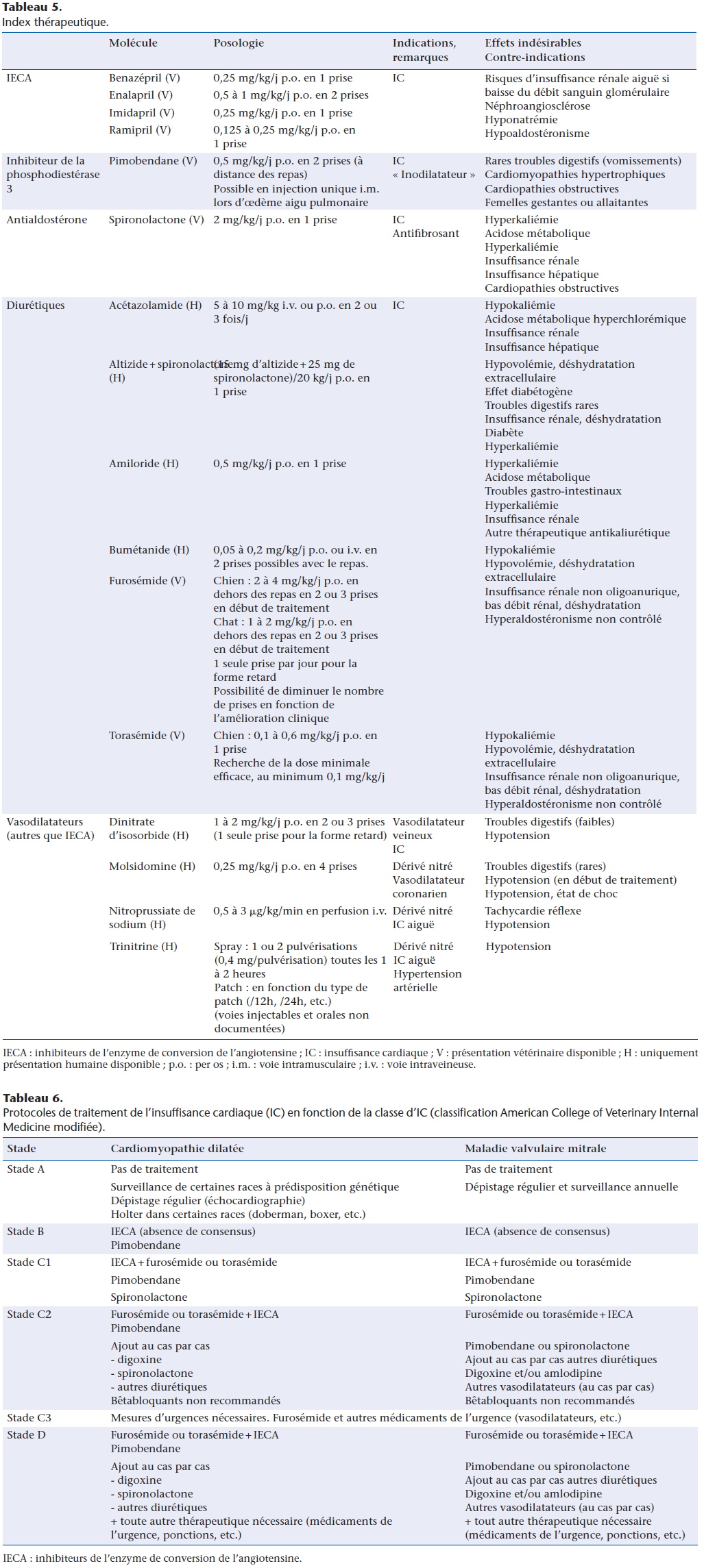
Schéma thérapeutique « ISACHC »
Dans ce schéma thérapeutique issu de la classification ISACHC apparaît l’absence de traitement nécessaire en stade 1 de la maladie. Cette notion n’est actuellement pas consensuelle et semblerait être race-dépendante (cf.supra).
Cette classification est celle qui a été la plus usitée pour les études cliniques qui préludent à la délivrance de l’autorisation de mise sur le marché pour les médicaments de l’IC.
Schéma thérapeutique « ACVIM » modifiée
Lors d’IC secondaire à une maladie valvulaire mitrale, des recommandations de traitement ont été rédigées par un comité d’experts issu de l’ACVIM, qui a réalisé une analyse selon une méthode de médecine factuelle (evidence-based medecine). Pour chaque stade de la maladie valvulaire mitrale se rapportant à la classification ACC, le comité a rassemblé et évalué, en quantité comme en qualité, les données scientifiques concernant le traitement. Pour chaque recommandation qui en découle, le comité a spécifiquement indiqué si tous les membres étaient d’accord (consensus) ou s’il y avait des divergences d’opinion sur ce point (absence de consensus), en précisant dans ce cas les motifs du désaccord.
Ces recommandations peuvent en fait s’appliquer à l’IC congestive quelle que soit son origine. Ils sont résumés dans le Tableau 6, qui indique en plus les différences de protocole pour chacune des deux entités les plus rencontrées en médecine canine : la MVD et la CMD.
Dans ces schémas thérapeutiques issus de la classification ACVIM apparaissent des axes de suivi et de gestion globale du cas (prévention, surveillance, etc.), en plus des recommandations thérapeutiques.
Polythérapie
La polythérapie est quasiment toujours obligatoire en cardiologie. Le traitement de l’IC est un véritable défi car il associe non seulement plusieurs classes thérapeutiques de l’IC mais, fréquemment, il nécessite de lui adjoindre les traitements d’autres affections.
Les effets bénéfiques mais également indésirables de ces « mélanges » sont parfois connus, mais pour un grand nombre d’entre eux la médecine fondée sur les preuves n’a pas encore bien défini les limites. De plus, les maladies intercurrentes, fréquentes par exemple chez le chien âgé, créent une sensibilité individuelle qui impose au clinicien une surveillance très régulière. Un suivi périodique à intervalles réguliers comportant des examens complémentaires pour suivre l’évolution de l’IC, mais aussi des examens biologiques pour vérifier la bonne tolérance des médicaments, s’impose. Leur fréquence dépend évidemment du stade l’IC et ils doivent être programmés au minimum à la fin de chaque consultation.
Observance
Un autre obstacle corollaire de cette polythérapie est la mauvaise observance. Les médicaments de plus en plus appétants aident à en diminuer l’impact, mais le clinicien doit systématiquement envisager avec le détenteur de l’animal le respect de l’observance et faire évoluer sa prescription en fonction des caractéristiques comportementales de l’animal.
L’éducation thérapeutique du maître est également une notion importante en cardiologie. Elle permet, par exemple, de révéler précocement les éventuels effets indésirables et de les contrer plus rapidement, ou d’adapter une dose de médicaments quotidiennement.
Cas particulier du chat
Les cardiomyopathies représentent la grande majorité des affections cardiaques du chat et parmi celles-ci, la CMH est de loin la plus fréquente.
Les cardiomyopathies félines représentent un groupe hétérogène de maladies musculaires cardiaques dans cette espèce, illustré par de nombreuses formes différentes : hypertrophiques, dilatées, restrictives, arythmogènes, non classées. Chaque forme présente des spécificités d’anomalies et des modifications morphologiques et hémodynamiques, avec des conséquences et manifestations variables. L’issue la plus fréquente de l’ensemble des cardiomyopathies félines est l’IC. En 2016, il y a peu d’études qui évaluent l’efficacité des traitements des cardiomyopathies félines, ainsi que la prise en compte du suivi de ces maladies et des animaux traités sur les moyen et long termes.
En dehors du traitement de l’IC congestive, il n’existe pas de consensus en 2016 permettant de décider la mise en place ou non d’un traitement lors de cardiomyopathie féline, et encore moins lorsqu’elle est asymptomatique.
Cardiomyopathies félines : quels traitements en phase asymptomatique ?
Seul le traitement des formes hypertrophiques est envisagé ici.
Une enquête [14] indique que la mise en place d’un traitement n’apparaît pas nécessaire lors de cardiomyopathie asymptomatique « simple ». En revanche, si cette dernière s’associe à d’autres éléments péjoratifs (comme par exemple une dilatation atriale gauche ou un mouvement systolique antérieur de la valve mitrale), le traitement semble pertinent. Les traitements les plus utilisés lorsque l’atrium gauche est dilaté sont les bêtabloquants (50 % des cliniciens), les IECA (25 %), le diltiazem (10 %), les antiagrégants plaquettaires (20 %). Lorsqu’un mouvement systolique antérieur mitral est présent, le traitement majoritaire utilise les bêtabloquants (94 % des cliniciens). L’intention de traiter ou de ne pas traiter ainsi que le choix d’un traitement sont subjectifs, en l’absence d’études pertinentes et fiables standardisant un protocole particulier, et en l’absence de l’observation d’effets des différents traitements en phase asymptomatique. Lors d’IC, les bêtabloquants sont peu utilisés, au profit du diltiazem (inhibiteur calcique).
Bêtabloquants ou inhibiteurs calciques ?
Les bêtabloquants sont utilisés pour diminuer les conséquences du mouvement systolique antérieur mitral, de l’obstruction dynamique de la chambre de chasse ventriculaire gauche ou bien de l’hypertrophie myocardique concentrique. L’aténolol est la molécule la plus prescrite, mais son efficacité n’est probablement pas à la hauteur des espoirs. Une étude [15] indique l’absence d’effets de cette molécule sur la mortalité, par rapport à l’absence de traitement, sur une période de suivi de plus de cinq ans.
Le diltiazem, inhibiteur calcique, a des effets lusitropes positifs qui améliorent la relaxation myocardique en fin de systole. Bien qu’ayant été largement utilisé depuis de nombreuses années et disposant même d’une autorisation de mise sur le marché (AMM) vétérinaire, son bénéfice n’est pas clairement démontré.
Inhibiteurs de l’enzyme de conversion de l’angiotensine
Il est possible que les IECA réduisent significativement l’hypertrophie ventriculaire gauche et améliorent le remplissage diastolique. Aucune preuve n’est disponible pour le moment de cette propriété intéressante [16].
Inhibiteurs de l’aldostérone
Jusqu’en 2016, aucun effet bénéfique n’a été observé avec cette molécule, considérant des paramètres d’évaluation échocardiographiques (masse ventriculaire gauche, fonction diastolique, taille de l’atrium gauche) [17]. Un risque de dermatite faciale est possible chez certains chats faisant suite à la prise de spironolactone.
Anticoagulants et antiagrégants plaquettaires
Lorsque l’atrium gauche est dilaté ou que des volutes préthrombiques sont visibles, la prescription d’antiagrégants plaquettaires est proposée mais sans justification démontrée.
Ivabradine
L’ivabradine est une nouvelle molécule, chronotrope négative, agissant par bocage des funny-channels du nœud sinusal. Ses effets de réduction de la fréquence cardiaque, et par conséquent d’amélioration du remplissage diastolique, ainsi que la réduction de l’obstruction dynamique, semblent intéressants, mais nécessitent de plus amples évaluations [18, 19].
Cardiomyopathies félines : quels traitements en phase symptomatique ?
La phase symptomatique est principalement caractérisée par des manifestations d’IC congestive gauche. Les traitements de choix sont les diurétiques de l’anse, principalement le furosémide (le torasémide est une molécule en cours d’évaluation), et les IECA. Les autres molécules précédemment développées n’ont pas montré d’effets bénéfiques chez ces animaux. Il apparaît même que certaines soient délétères, comme l’aténolol, augmentant la mortalité (Fox P., données non publiées).
Bien qu’il n’ait pas d’AMM pour cette espèce, le pimobendane peut être prescrit et utilisé chez le chat en complément d’autres molécules lors de cardiopathie et d’IC. Les médianes de survie ainsi obtenues sont mesurées entre 151 jours (chats insuffisants cardiaques, toutes cardiopathies confondues) [20] et 167 jours (chats insuffisants cardiaques, avec une dysfonction systolique, toutes cardiopathies confondues) [21]. Lors de CMH avec IC, il améliore l’espérance de vie, avec une médiane à 626 jours (contre 103 jours en l’absence de pimobendane) [22]. C’est également le cas lors de CMD, maladie rarement rencontrée actuellement chez le chat, avec une médiane de survie à 49 jours versus 12 jours sans cette molécule [23]. De plus amples études sont nécessaires afin de préciser ses indications et ses effets (différentes formes de cardiomyopathies, stades de l’IC, effets en phases asymptomatiques ?). Néanmoins, il apparaît intéressant de considérer cette molécule dans l’arsenal thérapeutique des maladies cardiaques avec IC chez le chat.
Traiter un chat qui présente une cardiomyopathie reste un défi pour le praticien, ne disposant pas d’un nombre d’études suffisamment probantes ou standardisées. Les enquêtes réalisées sur les habitudes de traitements des praticiens révèlent un rôle prépondérant de l’expérience personnelle. Le suivi du traitement de ces animaux et ses adaptations sont individuels, évalués au cas par cas, en fonction de l’évolution de l’état clinique du chat et des résultats des examens complémentaires.
Conclusion
La thérapeutique de l’IC a considérablement évolué grâce à un meilleur diagnostic, à l’apparition de nouveaux médicaments, à plusieurs études cliniques permettant de mieux bien connaître leurs effets bénéfiques et indésirables, et souvent leurs interactions, données particulièrement intéressantes puisque la polythérapie en cardiologie est plus que fréquente. Il reste encore de nombreuses inconnues. Le traitement des cardiomyopathies félines est au centre des préoccupations des cardiologues vétérinaires, mais la grande diversité de leurs phénotypes complique beaucoup la réalisation des études cliniques nécessaires pour objectiver l’efficacité du traitement envisagé.