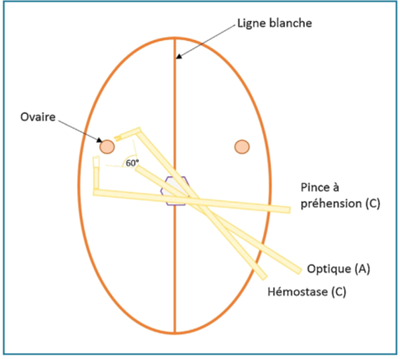
 Figure 5 - Ovariectomie à un port multitrocart (SILS™)
Figure 5 - Ovariectomie à un port multitrocart (SILS™)
Cette dernière technique nécessite une 3e main, et donc un assistant.
Cela oblige aussi à travailler en croisant ses mains.
Figure 6 - Le port SILS™ par Covidien®
Source photo : Medtronic.com consulté le 02/02/2016
Laparoscope avec canal opérateur
Le canal opérateur permet d’insérer les instruments souhaités. On passe en premier la pince à préhension pour fixer l’ovaire à la paroi abdominale. On passe ensuite la pince à hémostase. Cela est similaire à la technique à deux ports décrite plus haut [5]. Il s’agit généralement d’une canule de 10 mm associée à un canal opérateur de 6 mm permettant d’utiliser des instruments de 5 mm (Fig. 7). Cette technique est plus inconfortable pour le chirurgien car l’instrument est exactement dans le même axe que l’optique, ce qui empêche tout mouvement libre.
 Figure 7 - Optique de 10 mm associée à un canal opérateur de 6 mm qui permet l’insertion d’instrument de 5 mm.
Figure 7 - Optique de 10 mm associée à un canal opérateur de 6 mm qui permet l’insertion d’instrument de 5 mm.
Le canal optique est déporté de l’axe de l’instrument pour le raccordement de la caméra.
Comment réaliser l’hémostase ?
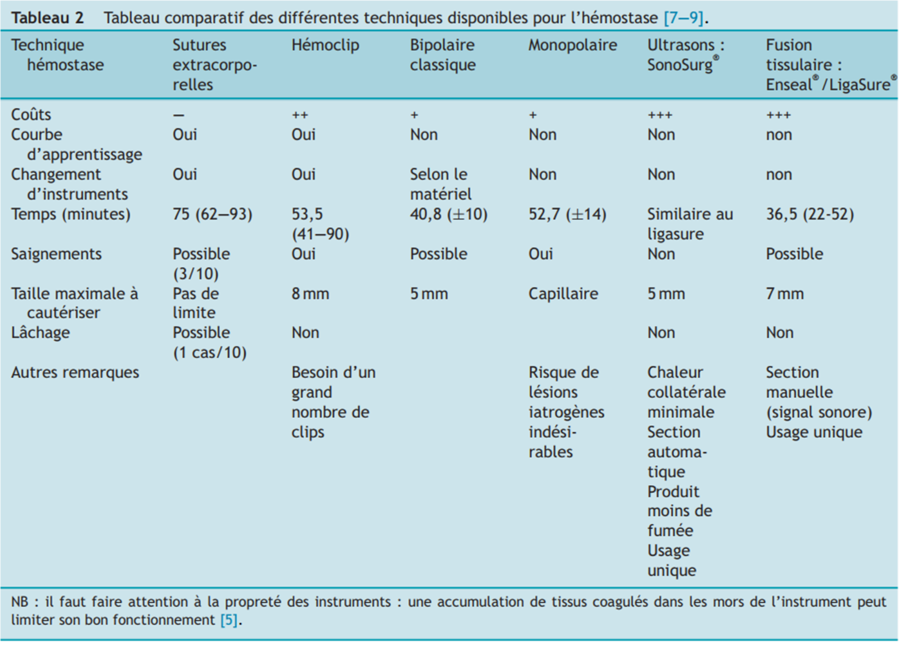
Différentes techniques ont été décrites pour réaliser l’hémostase : sutures extracorporelles (nœuds Roeder modifiés), hémoclip, dispositifs bipolaire ou monopolaire, laser, scalpel harmonique (ultrasons), ligature avec du fil en acier chirurgical, dispositif de fusion tissulaire (Tableau 2) [10]. La technique idéale d’hémostase doit être sûre, fiable et rapide. De nombreuses études ont comparé l’efficacité de ces différentes techniques [10—12]. Chaque technique d’hémostase est associée à une courbe d’apprentissage qui lui est propre.
La maîtrise de l’hémostase est d’autant plus importante lors de laparoscopie qu’il n’y a généralement pas de système d’aspiration à disposition pour éliminer le sang. Le champ visuel peut être rapidement limité, ce qui peut augmenter le temps opératoire ou peut nécessiter une conversion en laparotomie. La fréquence des saignements intra-opératoires augmente avec l’âge (et donc, le nombre de cycles œstraux) et le poids (ligament ovarien gras) [5, 11].
Des saignements minimes sont possibles lorsque les ovaires sont fixés (techniques à 1 et 2 ports) ou lorsque les pédicules sont sectionnés, et ce d’autant plus s’il y a un large tissu graisseux [5].
Hémostase : techniques mécaniques
Les techniques conventionnelles incluent principalement les hémoclips et les ligatures (ex. : nœuds de Roeder modifiés). Avec les hémoclips, il faut toujours s’attendre à quelques saignements, bien que sans conséquence [10]. C’est une technique consommatrice, une moyenne de 31 clips étant généralement nécessaire (2 cartouches). Un changement d’instrument est nécessaire pour pouvoir couper les pédicules après la mise en place des hémoclips. L’utilisation de ligatures est sûre, fiable, et peu coûteuse mais elle augmente significativement le temps opératoire [10].
Hémostase : électrocoagulation et fusion tissulaire
Les dispositifs plus récents, tels que le LigaSure®/Enseal®, Ultracision®/SonoSurg®, bistouris bipolaire et monopolaire sont efficaces mais doivent être utilisés avec précaution car ils peuvent dégager une forte chaleur. Cette dispersion latérale de la chaleur doit être minimale afin de limiter la cautérisation iatrogènique des tissus adjacents [10].
Électrocoagulation : monopolaire et bipolaire classiques
L’utilisation du monopolaire en chirurgie laparoscopique est généralement déconseillée car celui-ci peut provoquer des brûlures des tissus proches du manche du monopolaire ou ailleurs à cause du couplage capacitif, d’un défaut d’isolation ou d’un couplage direct [11]. L’hémostase est plus difficile et des ligatures sont souvent nécessaires. Le bipolaire réduit les risques de dégâts au niveau des tissus adjacents à la zone d’hémostase. Selon le type d’instrument utilisé, un changement d’instrument pour couper les tissus peut être nécessaire. Par exemple, il existe des pinces bipolaires intégrant une lame pour pouvoir couper les tissus coagulés (ex. : pince LAP bipolaire Maryland du fabriquant Erbe®).
Fusion tissulaire
Bien que plus coûteux, les dispositifs de fusion tissulaire par électrocoagulation (Force FX/LigaSure/Force triad® Covidien ou Enseal® Ethicon) ou ultrasons (SonoSurg® Olympus ou Harmonic® Ethicon) sont actuellement préférés car ils sont rapides, sûrs, et efficaces sur des vaisseaux de grande taille (≤ 5—7 mm selon l’instrument) (Fig 8). Ils sont tous disponibles en diamètre de 5 mm, ce qui permet leur utilisation avec des canules de 6 mm. Avec les dispositifs Sonosurg® et Enseal®, fusion et coupe sont couplées (la section est réalisée dans le même temps que la fusion), alors que ces deux étapes sont séparées avec le LigaSure® (le chirurgien réalise la section après fusion mais peut également fusionner sans sectionner). Ils ne nécessitent donc pas de changement d’instrument. À l’exception du Sonosurg®, ces dispositifs sont initialement destinés à un usage unique en médecine humaine. Pour répondre à cette problématique, des fabricants, tels que Erbe®, ont développé un système de fusion tissulaire bipolaire réutilisable (Biclamp®).
La diffusion de chaleur et les lésions aux organes adjacents sont minimisées avec ces dispositifs. Afin d’éviter toute lésion iatrogénique, et ce quel que soit le dispositif d’hémostase utilisé, il est recommandé d’écarter le tissu à cautériser des autres organes et de la paroi abdominale.
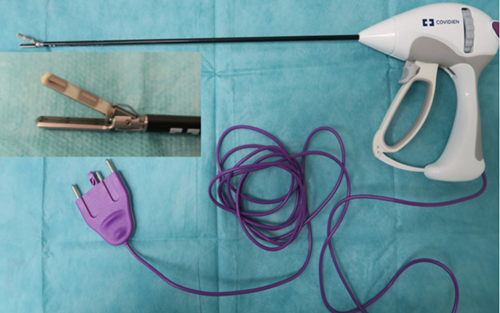 Figure 8 - LigaSure® pour laparoscopie
Figure 8 - LigaSure® pour laparoscopie
La longueur utile est de 37 cm et le diamètre de 5 mm.
L’électrode mesure 4,6 mm de large sur 1,8 cm de longueur.
Facteurs d’influence sur le temps chirurgical
Comme rapporté précédemment, le nombre de port(s) utilisé(s) ainsi que la technique d’hémostase ont une influence directe sur le temps chirurgical. Le poids de l’animal influence également ce temps [10]. Avec l’augmentation du poids, il y a une augmentation du tissu à cautériser et une plus grande difficulté pour accéder aux ovaires [10, 11].
Une plus grande quantité de tissu graisseux dans le ligament ovarien est associé à un temps chirurgical plus long [5].
Réduction de la douleur postopératoire
Il a été démontré que l’ovariectomie par laparoscopie permet une reprise d’activité plus rapide [13] et une diminution significative de la douleur [14] postopératoire par rapport à une ovariectomie conventionnelle. La douleur postopératoire est significativement moindre pour la technique à 2 ports par rapport à la technique à 3 ports mais n’est pas significativement différente entre les techniques à 1 et 2 ports [9]. Il n’y a pas d’association entre le nombre de port et la niveau de douleur liée à l’incision [9].
Comment réagir en cas d’utérus anormal ?
La réalisation d’une ovario-hystérectomie (OVH) de convenance chez un animal sain est tout à fait possible par laparoscopie. L’intervention est également faisable en cas de pyomètre, qu’il soit à col ouvert ou fermé [15, 16].
Il s’agit d’une OVH assistée par la laparoscopie. Diverses techniques ont été rapportées. On en retiendra que l’extraction de l’utérus est généralement réalisée en agrandissant l’incision de la canule caudale. Les ovaires et l’utérus sont extériorisés par cette incision, ce qui permet de poser les ligatures et transfixion sur le col utérin. Il a été démontré que les pinces à fusion tissulaire bipolaires sont efficaces sur le corps utérin et peuvent remplacer les ligatures : leur utilisation est déconseillée sur un corps utérin dépassant 9 mm de diamètre [17].
De la même fac ¸on que pour l’ovariectomie classique, la chirurgie peut être réalisée à l’aide de trois, deux ou un seul port [15, 16, 18]. En cas de complication, ou d’utérus de plus grande taille que attendu, la chirurgie doit être convertie en laparotomie classique. Le taux de conversion est actuellement inconnu en médecine vétérinaire.
Lors de pyomètre, une sélection minutieuse des candidats est nécessaire. Pour cela, certaines recommandations ont été émises [15] :
- il faut éviter la manipulation directe de l’utérus (corps et corne) avec les instruments ;
- une échographie abdominale préopératoire est nécessaire afin de mesurer le diamètre des cornes utérines.
En effet, la chirurgie est réalisable chez les chiens de moins de 10 kg chez lesquels le diamètre des cornes utérines est inférieur à 2 cm, les plus grands chiens chez lesquels les cornes utérines mesurent jusqu’à 4 cm.
Au-delà d’un diamètre de 4 cm, les cornes utérines gênent le champ de travail et deviennent très délicates à manipuler. Dans ce cas, une OVH classique est recommandée.
Conclusion
L’ovariectomie par laparoscopie se présente désormais comme une chirurgie sûre, rapide et moins douloureuse qu’une ovariectomie classique. Celle-ci permet une reprise de l’activité plus rapide. Le nombre de ports utilisés reste le choix du chirurgien en fonction de son expérience personnelle.
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.